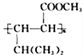题目内容
【题目】孔雀石等自然界存在的碳酸盐类铜矿的化学组成为xCuCO3·yCu(OH)2(x、y为正整数,且x≤3,y≤2)。
(1)现有两份等量的某碳酸盐类制矿样品,一份加足量盐酸,产生3.36L标准状况下的CO2气体,另一份加热完全分解得到20gCuO,则该碳盐类铜矿的化学组成中x:y=____。
(2)设某碳酸盐类铜矿样品质量为ag,含铜质量为bg,加酸完全分解得到标准状况下CO2气体VL,则a、b、V的代数关系式是_____。
【答案】3:2 a=![]() 或a=
或a=![]()
【解析】
(1)先计算一定质量的碳酸盐反应产生的CO2、CuO的物质的量,然后根据C元素守恒可得n(CuCO3)=n(CO2),根据Cu元素守恒可得n(CuCO3)+ n[Cu(OH)2]=n(CuO),计算出n[Cu(OH)2],就可得到n(CuCO3)与n[Cu(OH)2]的物质的量的最简整数比;
(2)根据碳元素守恒可得n(CuCO3)=n(CO2)=![]() ,根据Cu元素守恒可得n(CuCO3)+ n[Cu(OH)2]=n(Cu),用含有b、V的代数式表示,也可根据n(CuCO3)=n(CO2)=
,根据Cu元素守恒可得n(CuCO3)+ n[Cu(OH)2]=n(Cu),用含有b、V的代数式表示,也可根据n(CuCO3)=n(CO2)=![]() 先计算出CuCO3的质量,用总质量减去CuCO3的质量得到Cu(OH)2的质量,再计算其物质的量,最后得到n(CuCO3)与n[Cu(OH)2]的物质的量的最简整数比。
先计算出CuCO3的质量,用总质量减去CuCO3的质量得到Cu(OH)2的质量,再计算其物质的量,最后得到n(CuCO3)与n[Cu(OH)2]的物质的量的最简整数比。
(1)n(CO2)=3.36L÷22.4L/mol=0.15mol,则n(CuCO3)=n(CO2)=0.15mol,n(CuO)=20g÷80g/mol=0.25mol,根据Cu元素守恒,可得n[Cu(OH)2]=0.25mol-0.15mol=0.10mol,所以n(CuCO3):n[Cu(OH)2]=0.15:0.10=3:2,所以碳酸盐类铜矿的化学组成为xCuCO3·yCu(OH)2中x=3,y=2,盐可以表示为3CuCO3·2Cu(OH)2;
(2)根据C元素守恒可得n(CuCO3)=n(CO2)=![]() ,根据Cu元素可得n(CuCO3)+ n[Cu(OH)2]=n(Cu)=
,根据Cu元素可得n(CuCO3)+ n[Cu(OH)2]=n(Cu)=![]() mol,则n[Cu(OH)2]=
mol,则n[Cu(OH)2]=![]() )mol,所以n(CuCO3):n[Cu(OH)2]=
)mol,所以n(CuCO3):n[Cu(OH)2]=![]() :
:![]() ),a= a=
),a= a=![]() ;n(CuCO3)=n(CO2)=
;n(CuCO3)=n(CO2)=![]() ,m(CuCO3)=
,m(CuCO3)=![]() ×124g/mol=
×124g/mol=![]() ,该化合物含有Cu的总物质的量是n(Cu)
,该化合物含有Cu的总物质的量是n(Cu)![]() ,则根据Cu元素守恒,可得n[Cu(OH)2]=
,则根据Cu元素守恒,可得n[Cu(OH)2]=![]() ,m[Cu(OH)2]=98g/mol×(
,m[Cu(OH)2]=98g/mol×(![]() ),根据反应前后物质质量不变,可得a=
),根据反应前后物质质量不变,可得a=![]() +98g/mol×(
+98g/mol×(![]() )=
)=![]() 。
。