题目内容
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
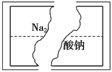
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A.AB.BC.CD.D
【答案】B
【解析】
A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,该无色气体可能为二氧化碳、二氧化硫,则溶液可能为Na2CO3溶液或Na2SO3溶液,故B错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,则原溶液是Na2SO3溶液,故C正确;
D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确;
故选B。

【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行