题目内容
对于(NH4)2SO4溶液,下列说法正确的是
A.溶液中存在电离平衡:(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
| B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 |
| C.加水稀释,溶液中所有离子的浓度均减小 |
| D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O) |
B
解析试题分析:A.硫酸铵为强电解质,在溶液中完全电离:(NH4)2SO4=2NH4+ + SO42-。B.向溶液中滴加少量浓硫酸,氢离子抑制铵根离子的水解,c(NH4+)与c(SO42-)均增大;C.加水稀释,溶液中c(H+)减小,根据水的离子积常数,溶液中氢氧根离子的浓度增大;D.溶液中,根据元素守恒:2c(SO42-)=c(NH4+) + c(NH3·H2O)。
考点:考查溶液中质子守恒、元素守恒和电荷守恒等相关知识。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是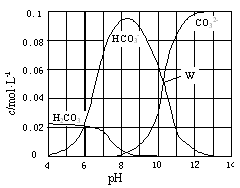
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
氢氟酸为弱酸。250C时将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是
①n(H+);②c(H+)·c(OH—);③c(OH—)+ c(F—);④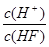 ;⑤
;⑤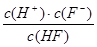 ;
;
| A.①③④ | B.②③④ | C.③④⑤ | D.②⑤ |
在0.2mol/L的CH3COOH溶液中分别加入下列物质后,有关判断正确的是
| A.适当升高温度,CH3COOH的电离程度减小 |
| B.加少量NaOH固体,CH3COOH 的电离平衡向正方向移动 |
| C.加少量0.1mol/L的HCl溶液,溶液中c(H+)增大平衡向正方向移动 |
| D.加少量CH3COONa固体,CH3COOH 的电离平衡平衡向正方向移动 |
下列说法正确的是
| A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10 |
| B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1 mol/L盐酸 ③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③ |
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有 c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO32-) |
| B.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为 NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1∶2 |
已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是 ( )
| A.所得溶液中的c(H+)=1.0×10-12 mol·L-1 |
| B.所加的烧碱溶液pH=12.0 |
| C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1 |
| D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1 |
25℃时,a mol·L-1一元酸HA溶液与b mol·L-1NaOH溶液等体积混合后,pH为7,则下列关系一定正确的是
| A.a=b | B.a>b | C.c(A-)= c(Na+) | D.c (A-)< c(Na+) |
图示化学变化的类型属于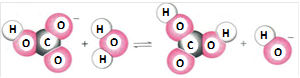
| A.取代 | B.水解 | C.中和 | D.电离 |