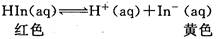题目内容
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是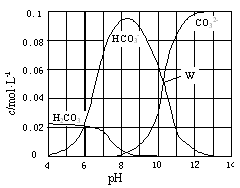
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
B
解析试题分析:A、根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) + c(HCO3-),错误;B、pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1,正确;C、根据图像可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32-)=c(Cl-)=1/2 c(Na+),则c(H+)+ 2c(H2CO3)+ 2c(HCO3-) = c(OH-)+c(Cl-),错误;D、根据图像可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32-) >c(Cl-)>c(HCO3-)>c(H2CO3),错误。
考点:考查离子浓度大小比较

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案在一定条件下,Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2,平衡向正反应方向移动 |
C.升高温度, 减小 减小 | D.加入NaOH固体,溶液pH减小 |
对于常温下pH为1的硝酸溶液,下列叙述正确的是
| A.该溶液lmL稀释至1000mL后,pH等于3 |
B.该溶液中水电离出的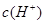 是pH为3的硝酸中水电离出的 是pH为3的硝酸中水电离出的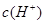 的100倍 的100倍 |
C.该溶液中硝酸电离出的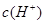 与水电离出的 与水电离出的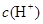 之比值为 之比值为 。 。 |
| D.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
| A.(V2-V1)/V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
W、X、Y、Z是原子序数依次增大的四种短周期元素,化合物WX能抑制水的电离,离子化合物Y2Z能捉进水的电离。则Y元素是
| A.Li | B.F | C.Na | D.Cl |
常温下,pH都等于9的NaOH溶液和CH3COONa两种溶液中,若由水电离产生OH- 浓度分别为a mol/L和b mol/L,则a和b的关系是
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
关于强弱电解质的叙述正确的是:( )
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.弱电解质的水溶液的导电能力比强电解质溶液弱 |
| D.强电解质的稀溶液中无溶质分子,弱电解质的溶液中存在溶质分子 |
对于(NH4)2SO4溶液,下列说法正确的是
A.溶液中存在电离平衡:(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
| B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 |
| C.加水稀释,溶液中所有离子的浓度均减小 |
| D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O) |