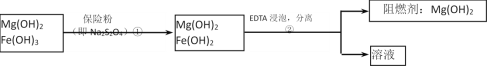
题目内容
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述正确的是
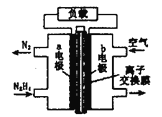
A. b极发生氧化反应
B. a极的反应式为N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电子从a极经过负载流向b极,再经溶液流回a极
D. 其中的离子交换膜需选用阳离子交换膜
【答案】B
【解析】A、燃料电池中,通入氧气的一极是正极,因为氧气腐蚀还原反应,所以b极发生还原反应,选项A错误;B、肼发生氧化反应,失去电子和氢氧根离子结合生成氮气和水,选项B正确;C、放电时,电流从正极流向负极,所以电流从b极经过负载流向a极,选项C错误;D、该电池中的电解质溶液是碱溶液,所以离子交换膜是阴离子交换膜,选项D错误,答案选B。

练习册系列答案
相关题目
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10