题目内容
2.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S
②酸性:H3PO4>H2SO4>HClO4
③金属性:Na>Mg>Al
④晶体的熔点:SiO2>NaCl>CCl4>SO2.
| A. | ③④ | B. | ①④ | C. | ②③ | D. | ①③④ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
③同周期从左到右金属性减弱;
④一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故①错误;
②非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4 故②错误;
③Na、Mg、Al属于同周期原子序数逐渐增大的元素,同周期从左到右金属性减弱,所以金属性:Na>Mg>Al,故③正确;
④SiO2、NaCl、CCl4、SO2分别为原子晶体、离子晶体、分子晶体、分子晶体,一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高,则晶体的熔点SiO2>NaCl>CCl4>SO2,故④正确;
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
10.一种无色气体100mL,由NH3、NO、CO2所组成,将此无色气体通过浓硫酸的洗气瓶后,发现气体减少了30mL.剩余气体继续通过Na2O2固体后,发现气体变成红棕色,再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内充满液体.则原混合气体中NH3、NO、CO2气体的体积比为( )
| A. | 5:8:12 | B. | 15:14:21 | C. | 10:14:21 | D. | 30:28:23 |
17.下列说法正确的是( )
| A. | 乙醇易溶于水,难溶于有机溶剂 | |
| B. | 苯的分子结构中含有碳碳双键 | |
| C. | 乙烯通入酸性KMn04溶液中,紫色褪去 | |
| D. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
14.下列实验基本操作及注意事主要出于安全考虑的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 酒精灯内酒精不能少于灯容积14 | ||
| C. | 实验结束后将试管清洗干净 | D. | 胶头滴管不能交叉使用 |
12.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )

| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是酒精溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
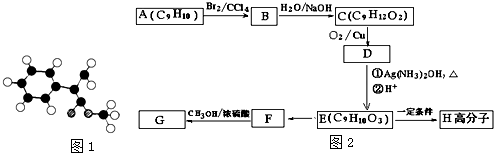
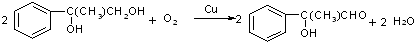 ;
;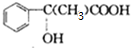
 +(n-1)H2O.
+(n-1)H2O.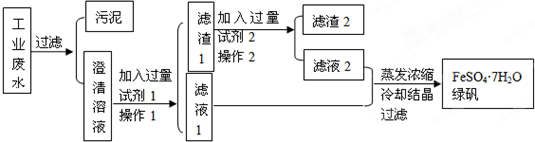
 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: ;
;