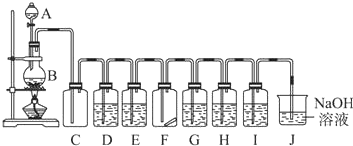
题目内容
13.某工厂的工业废水中含有大量的硫酸亚铁、较多的Cu2+和较少的Na+以及部分泥沙.为了减少污染并变废为宝,工厂计划从废水中回收绿矾和金属铜.请根据流程图完成实验方案.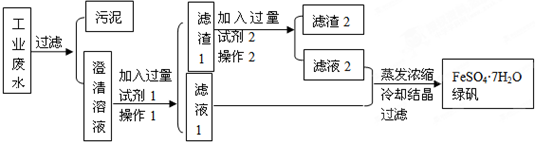
(1)操作1的名称过滤,在实验室完成该操作所需要的实验用品有:带铁圈的铁架台、烧杯、还有漏斗、玻璃棒、滤纸等.
(2)写出加入试剂或药品的名称:试剂1铁粉,试剂2稀硫酸.
(3)滤渣1所含物质的化学式为Fe 和Cu,滤渣2所含物质的化学式为Cu,滤液1中所含离子有Fe2+、SO42-和Na+.
(4)在澄清溶液中加入试剂1后发生化学反应,请写出该反应的离子方程式Fe+Cu2+=Fe2++Cu.
(5)物质1中加入试剂2后发生化学反应,请写出该反应的化学方程式Fe+H2SO4=FeSO4+H2↑.
分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂1为Fe,操作I为过滤,试剂2为稀硫酸,操作2为过滤,则滤液2中含硫酸亚铁,滤渣2为Cu,滤液1中含硫酸亚铁,然后蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
(1)固体和液体分离用过滤,依据过滤装置分析选择仪器;
(2)依据分析可知试剂1为过量铁试剂2为稀硫酸;
(3)铁和铜离子完全反应得到固体为铁和铜,滤液为硫酸钠、硫酸亚铁;
(4)在澄清溶液中加入试剂1后发生化学反应是铁置换铜;
(5)物质1中加入试剂2后发生化学反应是铁溶解于稀硫酸生成硫酸亚铁和氢气.
解答 解:工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂1为Fe,操作I为过滤,试剂2为稀硫酸,操作2为过滤,则滤液2中含硫酸亚铁,滤渣2为Cu,滤液1中含硫酸亚铁,然后蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
(1)由上述分析可知,操作1为过滤,分离不溶性固体与液体,在实验室完成该操作所需要的实验用品有:带铁圈的铁架台、烧杯、还有漏斗、玻璃棒、滤纸,
故答案为:过滤;还有漏斗、玻璃棒、滤纸;
(2)由上述分析可知,试剂1为Fe,发生Cu2++Fe=Fe2++Cu,试剂2为硫酸,铁粉、铜中加入适量稀硫酸,稀硫酸和铁粉反应生成硫酸亚铁,试剂1为铁粉,试剂2 为稀硫酸,
故答案为:Fe;稀硫酸;
(3)上述分析可知加入过量试剂铁和铜离子反应,过滤得到铜和铁为滤渣1,铁粉、铜中加H2SO4得到FeSO4,Cu不反应,则滤渣2为Cu,滤液1中所含离子有亚铁离子、硫酸根离子,钠离子等,所以滤渣1为 Fe 和Cu,滤渣2为 Cu,滤液1 为Fe2+、SO42-和Na+.
故答案为:Fe和Cu;Cu;Fe2+、SO42-和Na+;
(4)加入试剂1后发生化学反应,其离子反应为Cu2++Fe=Fe2++Cu,故答案为:Cu2++Fe=Fe2++Cu;
(5)加入试剂2后发生化学反应,其反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,故答案为:Fe+H2SO4=FeSO4+H2↑.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,把握实验流程中的试剂及发生的反应、混合物分离方法为解答的关键,侧重分析与推断能力的考查,注意物质的性质、物质之间的反应,题目难度不大.

| A. | 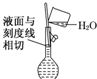 配制溶液 | B. | 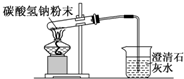 碳酸氢钠受热分解 | ||
| C. |  制备乙酸乙酯 | D. |  制备收集干燥的氨气 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点:H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的速率:L<Q | D. | L2+与R2-的核外电子数相等 |
| A. | NaF=NaCN | B. | NaF>NaCN | C. | NaF<NaCN | D. | 无法确定 |
①热稳定性:H2O>HF>H2S
②酸性:H3PO4>H2SO4>HClO4
③金属性:Na>Mg>Al
④晶体的熔点:SiO2>NaCl>CCl4>SO2.
| A. | ③④ | B. | ①④ | C. | ②③ | D. | ①③④ |
| A. | 蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台 | |
| B. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |