题目内容
下列各组比较不正确的是 ( )
| A.锂与水反应不如钠与水反应剧烈 |
| B.还原性:K>Na>Li,故 |
| C.容沸点:Li>Na>K |
| D.原子半径:Li<Na<K |
B
解析试题分析:K非常的活泼,可以和水反应,故把K放入NaCl溶液中,会立即与水反应,而不会置换出金属钠,故B错误。
考点:考查了元素周期律。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
运用元素周期律分析下列推断,其中错误的是
| A.铍是一种轻金属,它的氧化物的水化物可能具有两性 |
| B.砹单质是一种有色固体,砹化氢很不稳定 |
| C.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
| D.硫酸锶难溶于水 |
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
| A.元素原子的核外电子排布呈周期性变化 |
| B.元素的原子半径呈周期性变化 |
| C.元素的化合价呈周期性变化 |
| D.元素的金属性、非金属性呈周期性变化 |
下列说法中,正确的是 ( )
| A.H35Cl、H37Cl属于同素异形体 |
| B.16O与18O的中子数不同,核外电子排布却相同 |
| C.稳定性:CH4>SiH4;还原性:HCl>H2S |
| D.K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强 |
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
| A.非金属性比硫强 | B.氢化物比HBr稳定 |
| C.原子序数为34 | D.最高价氧化物的水化物显碱性 |
下列事实一般不能用于判断金属性强弱的是( )
| A.金属的颜色和熔沸点 |
| B.金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C.1mo金属单质在反应中失去电子的多少 |
| D.金属元素的单质和水或酸置换出氢的难易 |
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D.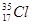 与 与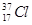 得电子能力相同 得电子能力相同 |
最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是( )
| A.与C60中普通碳原子的化学性质不同 | B.与14N含的中子数相同 |
| C.是C60的同素异形体 | D.与12C互为同位素 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Y、M的单质分别与水反应,Y最剧烈
C.X、Z、R的最高价氧化物的水化物之间可两两相互反应
D.Y的氧化物水化物的酸性一定强于R的的氧化物水化物的酸性