题目内容
最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是( )
| A.与C60中普通碳原子的化学性质不同 | B.与14N含的中子数相同 |
| C.是C60的同素异形体 | D.与12C互为同位素 |
D
解析试题分析:A.由于与C60中14C与普通碳原子都属于同一元素,因此它们的化学性质相同。错误。B. 14C的质子数是6,中子数是8,而14N质子数是7中子数是7,故含的中子数不相同。错误。C. 14C是原子表示单质,因此不是C60的同素异形体。错误。D. 14C与12C质子数都是6,中子数不同,因此互为同位素。正确。
考点:考查原子的构成微粒及同位素、同素异形体的概念的辨析和应用的知识。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
短周期元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
下列各组比较不正确的是 ( )
| A.锂与水反应不如钠与水反应剧烈 |
| B.还原性:K>Na>Li,故 |
| C.容沸点:Li>Na>K |
| D.原子半径:Li<Na<K |
下列叙述中正确的是
| A.卤素单质与水反应均可用X2+H2O===HXO+HX表示 |
| B.从F2到I2,卤素单质的颜色随着相对分子质量的增大而加深 |
| C.熔、沸点:Li>Na>K |
| D.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y |
(6分)(2012?广东)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )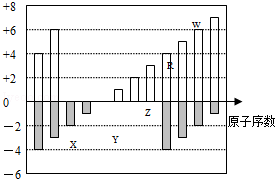
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |