题目内容
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
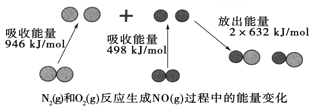
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。
【答案】H2(g)+![]() O2(g)===H2O(l) ΔH=-286 kJ/mol)391+226.7 kJ·mol-1
O2(g)===H2O(l) ΔH=-286 kJ/mol)391+226.7 kJ·mol-1
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=m/M计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)根据反应热等于反应物的总键能-生成物的总键能求算;
(3)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
利用盖斯定律将①×2+②×![]() - ③×
- ③×![]() 计算反应热。
计算反应热。
(1)4g氢气即2mol在O2中完全燃烧生成液态水,放出572kJ的热量,则1mol氢气在氧气中燃烧生成液态水,放出286kJ的热量,则表示H2的燃烧热的热化学方程式为:H2(g)+1/2O2(g)═H2O(l)△H=-286kJ/mol,
故答案为:H2(g)+![]() O2(g)═H2O(l)△H=-286kJ/mol;
O2(g)═H2O(l)△H=-286kJ/mol;
(2)N2(g)+3H2(g)![]() 2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,解得:a=391 kJmol-1,
2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,解得:a=391 kJmol-1,
故答案为:391;
(3)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
利用盖斯定律将①×2+②×![]() - ③×
- ③×![]() 可得:
可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+1/2×(-571.6kJ/mol)-1/2×(-2599 kJ/mol)=+226.7kJmol-1,
故答案为:+226.7kJmol-1。

 能力评价系列答案
能力评价系列答案