题目内容
【题目】题图中:E1=134kJ·mol-1,E2=368kJ·mol-1,根据要求回答问题:
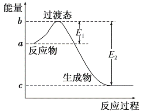
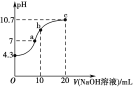
(1)如图是1molNO2(g)和1 molCO(g)反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为_______。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
请写出1 mol甲醇不完全燃烧生成1 mol 一氧化碳和液态水的热化学方程式:_______。
【答案】NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234kJ·mol-1 CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1 CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ/mol
O2(g)===CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1 CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ/mol
【解析】
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368kJ-134kJ=234kJ;
(2)依据热化学方程式,利用盖斯定律进行计算;
(3)依据热化学方程式,利用盖斯定律进行计算。
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368kJ-134kJ=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)依据盖斯定律②×3-①×2+③×2可得CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l),则ΔH=(-192.9 kJ·mol-1)×3-(+49.0 kJ·mol-1)×2+(-44kJ·mol-1)×2=-764.7kJ·mol-1,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l),则ΔH=(-192.9 kJ·mol-1)×3-(+49.0 kJ·mol-1)×2+(-44kJ·mol-1)×2=-764.7kJ·mol-1,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1;
(3)根据盖斯定律(①-②+③×4)÷2可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=[-1275.6kJmol-1-(-566.0kJmol-1)+4×(-44.0kJmol-1)]÷2=-442.8 kJmol-1 ,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJmol-1。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。