题目内容
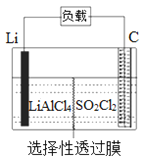
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为Na ,则E为________, A与水反应的离子方程式为____________________
(2)若A为Na2O2 ,则E为________, A与CO2反应的化学方程式为____________________,每有1mol Na2O2参加反应,转移电子数为________NA
(3)①A不论是Na还是Na2O2,依据转化关系判断物质B是________物质C是________
②向饱和的C溶液中通入CO2会析出白色晶体,该晶体为________,用化学方程式表示其反应原理为:_____________________
③将1mol/L的B溶液逐滴加入到1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为________L或者________L
【答案】H22Na+2H2O=2Na++2OH-+H2↑O22Na2O2+2CO2![]() 2Na2CO3+O21NaOHNa2CO3NaHCO3Na2CO3+CO2+ H2O
2Na2CO3+O21NaOHNa2CO3NaHCO3Na2CO3+CO2+ H2O![]() 2NaHCO3↓1.53.5
2NaHCO3↓1.53.5
【解析】
考查无机物的推断,(1)假设A为Na,则Na与H2O反应生成NaOH和H2,即E为H2,B为NaOH,C为Na2CO3,D为NaHCO3;(2)假设A为Na2O2,Na2O2与H2O反应生成O2和NaOH,与(1)类似;(3)根据(1)和(2)的分析,以及钠及其化合物的性质进行分析。
(1)若A为Na,Na与H2O反应:2Na+2H2O=2NaOH+H2↑,则单质E为H2,B为NaOH,CO2与NaOH反应:2NaOH+CO2=Na2CO3+H2O,继续通入CO2:Na2CO3+CO2+H2O=2NaHCO3,A与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(2)若A为Na2O2,则Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,则单质E为O2,Na2O2与CO2能发生反应:2Na2O2+2CO2=2Na2CO3+O2,Na2O2与CO2反应,Na2O2既是氧化剂又是还原剂,因此1molNa2O2与CO2反应转移电子物质的量为1mol,电子数为NA;(3)①根据上述分析,B为NaOH,C为Na2CO3;②NaHCO3的溶解度小于Na2CO3,因此向饱和的Na2CO3溶液中通入CO2,产生NaHCO3沉淀;其反应Na2CO3+CO2+H2O=2NaHCO3↓;③如果只发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,n(AlCl3)=1mol,n[Al(OH)3]=39/78mol=0.5mol,即AlCl3过量,消耗NaOH的体积0.5×3/1L=1.5L;氢氧化铝为两性氢氧化物,NaOH稍微过量,发生的反应是AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,AlCl3全部参与反应,生成氢氧化铝的总物质的量为1mol,此时消耗NaOH的物质的量为3mol,最后沉淀的物质的量为39/78mol=0.5mol,即有(1-0.5)mol氢氧化铝被消耗,同时该反应中消耗NaOH的物质的量为0.5mol,总共消耗氢氧化钠的物质的量为3.5mol,体积为3.5/1L=3.5L。

【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______