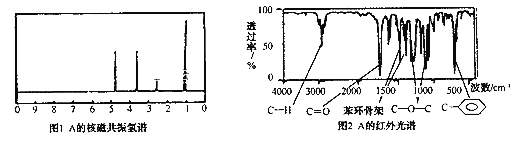
题目内容
【题目】(1)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_________;
②若所得混合溶液pH=2,则a:b=__________。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ___________
【答案】大于 10:1 9:2 Fe2O3
【解析】
(1)水的电离为吸热的过程,温度升高,促进水的电离,水的离子积增大;
①混合溶液为中性,说明n(H+)=n(OH-);
②混合溶液中c(H+)=![]() =10-2mol/L,接触a:b的值;
=10-2mol/L,接触a:b的值;
(2)把FeCl3溶液蒸干时,Fe3+水解生成Fe(OH)3和HCl,升高温度促进了HCl的挥发,灼烧实际上灼烧的是Fe(OH)3;
(1)水的电离为吸热的过程,温度升高,促进水的电离,水的离子积增大,因此当水的KW=10-13时,该温度填大于25℃;
①混合溶液为中性,说明n(H+)=n(OH-),因此0.01mol/L×aL=0.1mol/L×bL,那么a:b=0.1:0.01=10:1;
②混合溶液中c(H+)=![]() =10-2mol/L,解得a:b=9:2;
=10-2mol/L,解得a:b=9:2;
(2)把FeCl3溶液蒸干时,Fe3+水解生成Fe(OH)3和HCl,升高温度促进了HCl的挥发,灼烧实际上灼烧的是Fe(OH)3,最终得到的是红棕色固体Fe2O3。

【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示:
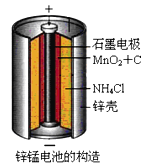
![]()
(1)锌锰干电池的电路中每通过![]() ,理论上负极质量减少 ______ g;工作时
,理论上负极质量减少 ______ g;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______
的微粒,正极的电极反应式是 ______
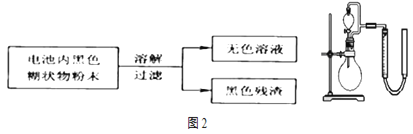
(2)某研究小组对电池内黑色糊状物进行了下列实验:
已知:![]() 是两性氢氧化物,完成下列实验报告:
是两性氢氧化物,完成下列实验报告:
实验步骤 | 实验现象 | 实验结论和解释 |
取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ | 无色溶液中存在 检验 |
(3)利用残渣中分离出的![]() ,研究其在
,研究其在![]() 制
制![]() 过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积
过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积![]() 溶液加入烧瓶中,分别进行2个实验
溶液加入烧瓶中,分别进行2个实验![]() 气体的体积在相同条件下测定
气体的体积在相同条件下测定![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量 | 收集到56mL气体 |
|
实验二 | 足量 | 黑色粉末部分溶解,收集到112mL气体 |
|
实验1、2中参加反应的![]() 的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
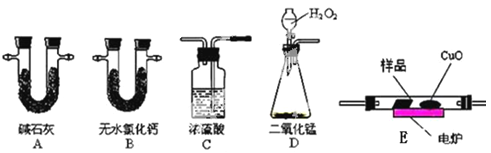
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。
【题目】某温度下,在三个体积均为2L的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | a | a | t1 |
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t1 |
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅰ>容器Ⅲ
C.反应到达平衡时,a>0.2 mol
D.起始时向容器Ⅲ中充入0.30 mol PCl5(g)、0.45 molPCl3(g)和0.10 mol Cl2(g),则反应朝逆向进行