题目内容
【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
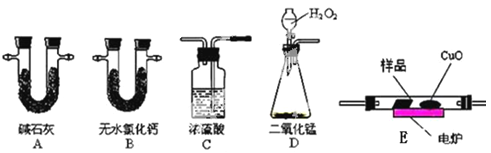
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。
【答案】D→C→E→B→A B A 样品的摩尔质量 CH3CHO 2
【解析】
实验原理是通过测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2。
(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选装置的连接顺序应是:D→C→E→B→A。
(2)根据分析可知,有机物燃烧生成水的质量用无水氯化钙的质量变化确定,生成二氧化碳的质量用碱石灰的质量变化确定,而碱石灰能够吸收水和二氧化碳,所以应该先用B无水氯化钙测定水的质量,然后用A碱石灰测定二氧化碳的质量,故①、②分别指的装置为B、A。
(3)根据燃烧规律,可以计算产物二氧化碳以及水的质量,进而计算碳原子和氢原子的数目,根据质量守恒,可以计算是否含有氧元素以及氧原子的数目,进而得到有机物的最简式,要确定分子式,需要再知道样品的摩尔质量。
(4)4.4g该有机物燃烧生成二氧化碳8.8g,二氧化碳的物质的量为:![]() =0.2mol,则m(C)=12g/mol×0.2mol=2.4g。生成水3.6g,产生水的物质的量为
=0.2mol,则m(C)=12g/mol×0.2mol=2.4g。生成水3.6g,产生水的物质的量为![]() =0.2mol,则m(H)=1g/mol×0.2mol×2=0.4g,由于m(C)+m(H)=2.4g+0.4g=2.8g<4.4g,则该有机物分子中一定含有氧元素,含有氧原子的物质的量为:
=0.2mol,则m(H)=1g/mol×0.2mol×2=0.4g,由于m(C)+m(H)=2.4g+0.4g=2.8g<4.4g,则该有机物分子中一定含有氧元素,含有氧原子的物质的量为:![]() =0.1mol。相同条件下,若该有机物蒸气对氢气的相对分子质量为22,则其相对分子质量为:2×22=44,4.4g该有机物的物质的量为:
=0.1mol。相同条件下,若该有机物蒸气对氢气的相对分子质量为22,则其相对分子质量为:2×22=44,4.4g该有机物的物质的量为:![]() =0.1mol,该有机物分子中含有C、H、O原子数为:N(C)=0.2mol÷0.1mol=2、N(H)=0.4mol÷0.1mol=4、N(O)=0.1mol÷0.1mol=1,所以该有机物的分子式为:C2H4O;该有机物的核磁共振氢谱上有两个峰,即含有两种类型的氢原子,其强度比为3:1,即两种类型的氢原子数目之比是3:1,则该有机物的结构简式为:CH3CHO;该有机物的相对分子质量为44,根据商余法:44÷14=3…2,则与该有机物相对分子质量相同的烃为丙烷:C3H8,丙烷分子中含有2种等效氢原子,其一氯代物有2种。
=0.1mol,该有机物分子中含有C、H、O原子数为:N(C)=0.2mol÷0.1mol=2、N(H)=0.4mol÷0.1mol=4、N(O)=0.1mol÷0.1mol=1,所以该有机物的分子式为:C2H4O;该有机物的核磁共振氢谱上有两个峰,即含有两种类型的氢原子,其强度比为3:1,即两种类型的氢原子数目之比是3:1,则该有机物的结构简式为:CH3CHO;该有机物的相对分子质量为44,根据商余法:44÷14=3…2,则与该有机物相对分子质量相同的烃为丙烷:C3H8,丙烷分子中含有2种等效氢原子,其一氯代物有2种。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案