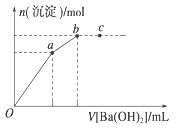
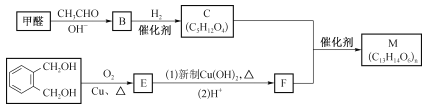
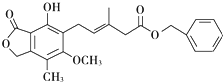
题目内容
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2H++2CrO42-(黄色)。
2H++2CrO42-(黄色)。
①向2mL0.1mol·L-1K2Cr2O7溶液中滴入3滴6mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:Cr2O72-+8H++3SO32-=2Cr3+(绿色)+3SO42-+4H2O。下列分析正确的是()
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
【答案】B
【解析】
试题分析:A、在酸性条件下,CrO42-转化为强氧化性的Cr2O72-,后者再将还原性较强的S2-氧化为S,A错误;B、实验②中含降价元素的Cr2O72-是氧化剂、升价元素的SO32-是还原剂,则SO42-是氧化产物,该反应中氧化剂的氧化性大于氧化产物,B正确;C、稀释K2Cr2O7溶液时,Cr2O7 2-、H+、CrO42-的浓度均减小,但Kw不变,因此该溶液中OH-浓度增大,C错误;D、实验①加碱或加酸的实质是减小或增大H+浓度,溶液颜色的变化说明了平衡逆(或正)向移动,证明该反应存在化学平衡,②还原性溶液的实质是减小Cr2O7 2-浓度,溶液颜色变化说明存在化学平衡且逆向移动,D错误;答案选B。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】如表是元素周期表的一部分,按要求填空( 填元素符号或化学式):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①元素的元素名称 .
(2)写出⑩元素的元素符号 .
(3)⑨在元素周期表中的位置:第 周期,第 族.
(4)在这些元素中, 是最活泼的金属元素; 是最活泼的非金属元素; 是最不活泼的元素.(用元素符号填写)
(5)能形成气态氢化物,且气态氢化物最稳定的是 .(用化学式填写)
(6)这些元素的最高价氧化物对应水化物中最强的酸是 ;最强的碱是 ;具有两性的氢氧化物是 .(用化学式填写)
(7)从⑤到的元素中, 原子半径最小.(用元素符号填写)
(8)比较⑤与⑥的化学性质, 更活泼(用元素符号填写),试用实验证明此现象(简述实验操作、现象和结论) .
(9)用电子式表示元素④与⑥形成的化合物: ,该化合物属于 (填“共价”或“离子”)化合物.