题目内容
【题目】EPR橡胶(![]() )和PC塑料(
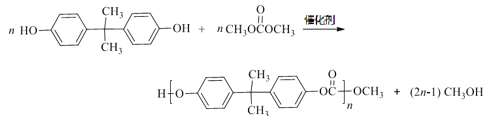
)和PC塑料( )的合成路线如下:
)的合成路线如下:

(1)A的名称是 ___________。
(2)C的结构简式____________。
(3)下列说法正确的是(选填字母)_______________。
A. 反应Ⅱ的原子利用率为100%
B. 反应Ⅲ为取代反应
C. 1 mol E与足量金属 Na 反应,最多可生成标准状况下22.4 L H2
D. CH3OH在合成PC塑料的过程中可以循环利用
(4)反应Ⅰ的化学方程式是_______________________________。
(5)反应Ⅳ的化学方程式是_______________________________。
(6)已知:

以D和乙酸为起始原料合成![]() 无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
【答案】 丙烯 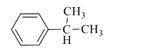 ACD
ACD 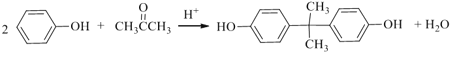
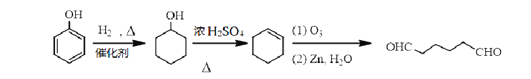
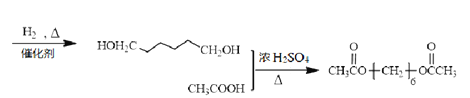
【解析】试题分析:根据EPR橡胶的结构简式,逆推A是丙烯、B是乙烯;丙烯与苯生成C,则C是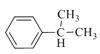 ;
; 氧化为C6H6O,C6H6O是
氧化为C6H6O,C6H6O是![]() ;
;![]() 与丙酮反应生成C15H16O2,C15H16O2与
与丙酮反应生成C15H16O2,C15H16O2与![]() 反应生成PC,根据PC的结构简式可知C15H16O2的结构简式是
反应生成PC,根据PC的结构简式可知C15H16O2的结构简式是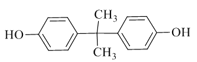 ;
;![]() 与甲醇反应生成
与甲醇反应生成![]() 和E,根据元素守恒,E是乙二醇。
和E,根据元素守恒,E是乙二醇。
解析:根据以上分析,(1)A是丙烯。(2)C是 。(3)乙烯与氧气反应生成环氧乙烷的原子利用率为100%,故A正确;
。(3)乙烯与氧气反应生成环氧乙烷的原子利用率为100%,故A正确; 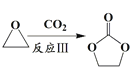 为加成反应,故B错误; E是乙二醇,1 mol 乙二醇与足量金属 Na 反应,最多可生成标准状况下22.4 L H2,故C正确;
为加成反应,故B错误; E是乙二醇,1 mol 乙二醇与足量金属 Na 反应,最多可生成标准状况下22.4 L H2,故C正确; 、
、![]() 生成
生成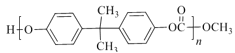 和CH3OH,所以甲醇可以循环利用,故D正确。(4)苯酚和丙酮反应生成
和CH3OH,所以甲醇可以循环利用,故D正确。(4)苯酚和丙酮反应生成 的的化学方程式是
的的化学方程式是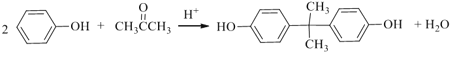 。(5);
。(5); 、
、![]() 生成
生成 和CH
和CH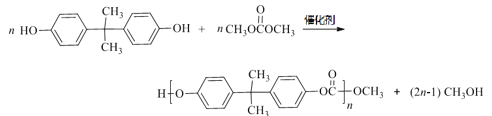 。
。
(6)![]() 与氢气发生加成反应生成环己醇,环己醇在浓硫酸作用下发生消去反应生成环己烯,环己烯氧化为
与氢气发生加成反应生成环己醇,环己醇在浓硫酸作用下发生消去反应生成环己烯,环己烯氧化为![]() ;
;![]() 还原为
还原为![]() ,
,![]() 与乙酸发生酯化反应生成
与乙酸发生酯化反应生成![]() ;合成路线为
;合成路线为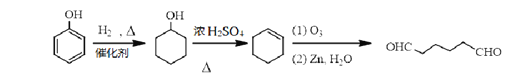
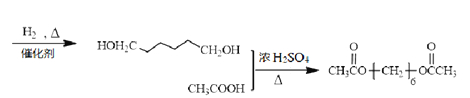 。
。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
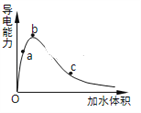
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
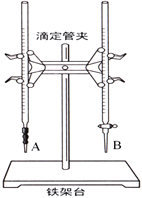
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
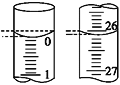
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。