题目内容
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2)己知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2)原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
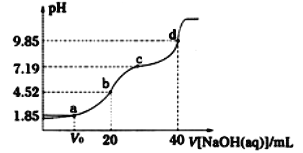
实验测得平衡时的有关变化曲线如图所示
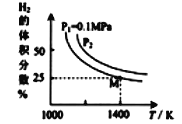
①由图可知,该反应的ΔH____0(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____(选填编号)。
A.V正(H2)=V逆(H2O)
B再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____(MPa)2
【答案】 2 6 12 1 1 12 9H2O △H1 +2△H2 2.8 >(1分) > B 66.7% 0.01
【解析】试题分析:(1)Mo元素化合价由0升高为+6,氮元素化合价由+5降低为+4,根据元素守恒,有水生成,根据电子守恒配平方程式;(2)根据盖斯定律计算ΔH3;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低;(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动;②A、达到平衡时,正逆反应速率相等;BMoS2是固体,再加入MoS2,平衡不移动; C.正反应气体质量增大,所以反应过程中气体密度增大;D.正反应气体物质的量增大,容器内压强是变量;③利用“三段式”计算M点时氢气的平衡转化率;④根据M点的平衡常数K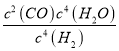 计算M点的平衡常数KP
计算M点的平衡常数KP
解析:(1)根据元素守恒,有水生成,根据都是电子守恒、元素守恒配平方程式为2Mo+6HF+12HNO3=MoO2F2+MoOF4+12NO2↑+9H2O;(2)①2Mo(s)+3O2(g)=2MoO3(s) ΔH1;②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2 ;根据盖斯定律②![]() ①得2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3=△H1 +2△H2;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低,2mol MoS2消耗7mol O2,转移28mol电子,所以0.2molMoS2参加反应,则转移电子2.8mol。(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动,正反应吸热,ΔH>0;②A、达到平衡时,正逆反应速率相等,所以达到平衡时V正(H2)=V逆(H2O),故A正确;B、MoS2是固体,再加入MoS2,平衡不移动,H2转化率不变,故B错误; C.正反应气体质量增大,所以反应过程中气体密度增大,密度不变时,一定达平衡状态,故C正确;D.正反应气体物质的量增大,容器内压强是变量,所以容器内压强不变时,一定达平衡状态,故D正确;
①得2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3=△H1 +2△H2;2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g)反应中Mo、S化合价都升高,只有氧元素化合价降低,2mol MoS2消耗7mol O2,转移28mol电子,所以0.2molMoS2参加反应,则转移电子2.8mol。(3)①由图可知,升高温度氢气的体积分数降低,说明平衡正向移动,正反应吸热,ΔH>0;②A、达到平衡时,正逆反应速率相等,所以达到平衡时V正(H2)=V逆(H2O),故A正确;B、MoS2是固体,再加入MoS2,平衡不移动,H2转化率不变,故B错误; C.正反应气体质量增大,所以反应过程中气体密度增大,密度不变时,一定达平衡状态,故C正确;D.正反应气体物质的量增大,容器内压强是变量,所以容器内压强不变时,一定达平衡状态,故D正确;
③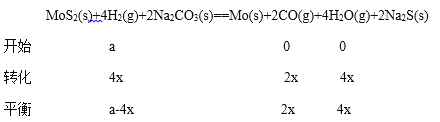
![]() ,a=6x,M点时氢气的平衡转化率
,a=6x,M点时氢气的平衡转化率![]() 66.7%;④根据方程式H2、CO、H2O=2x:2x:4x,氢气体积分数是25%,所以CO、H2O的体积分数分别是25%、50%,则KP=
66.7%;④根据方程式H2、CO、H2O=2x:2x:4x,氢气体积分数是25%,所以CO、H2O的体积分数分别是25%、50%,则KP=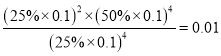 (MPa)2
(MPa)2

【题目】二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:
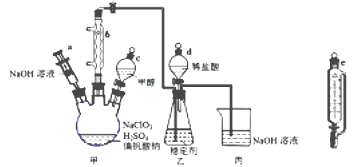
(1)仪器b的名称为________,其作用是_____________。
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式____________________。
(3)甲装置中采取的加热方式是________________,如果滴加甲醇的速度过快,可造成的后果____________。
(4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗,你认为他的理由是______________________。
(5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是____________。
(6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是_______( 填"1”或“2”),原因是________________________________。
时间/天 稳定剂 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
稳定剂1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
稳定剂2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62-) 。达到滴定终点时用去18.00mlNa2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1