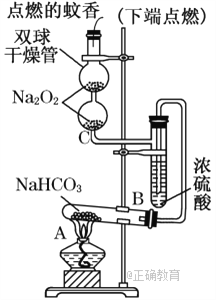
题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系错误的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣)
B.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO ![]() )+3c(HCO3﹣)+3c(H2CO3)
)+3c(HCO3﹣)+3c(H2CO3)
C.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O ![]() )+c(HC2O
)+c(HC2O ![]() )+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+)
)+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+)
D.0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3?H2O)>c(NH ![]() )>c(Cl﹣)>c(OH﹣)
)>c(Cl﹣)>c(OH﹣)
【答案】D
【解析】解:A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合,生成等物质的量CH3COOH和NaCl,钠离子与氯离子不水解,二者的浓度相同,即c(Na+)=c(Cl﹣),CH3COOH是弱酸在溶液中部分电离,所以c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣),故A正确;B.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合,钠离子的总浓度是C的最浓度的1.5倍,所以溶液中:2c(Na+)=3c(CO ![]() )+3c(HCO3﹣)+3c(H2CO3),故正确;
)+3c(HCO3﹣)+3c(H2CO3),故正确;
C.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸)生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒为:2c(C2O ![]() )+c(HC2O
)+c(HC2O ![]() )+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+),故C正确;
)+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+),故C正确;
D.0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合,溶液显碱性,NH3H2O的电离程度大于NH4+的水解程度,所以溶液中c(NH ![]() )>c(Cl﹣)>c(NH3H2O)>c(OH﹣),故D错误.
)>c(Cl﹣)>c(NH3H2O)>c(OH﹣),故D错误.
故选D.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案