题目内容
【题目】A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物及其最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (选“A”或“D”)。
(2)元素C在元素周期表中的位置是 ,B的最高价氧化物对应的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为 。
【答案】(1)D
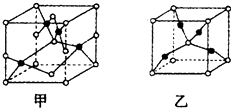
(2)第三周期ⅢA族![]()
(3)次氯酸钙 ClO-+2H++Cl-=Cl2↑+H2O
【解析】试题分析:A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,则A是氧元素。D的氢化物及其最高价氧化物对应的水化物均为强酸,则D氯元素。B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水,所以B是Na、C是Al。E和其他元素既不在同一周期也不在同一主族,则E是Ca。
(1)水分子间存在氢键,常温下水是液态,氯化氢是气态,则A和D的氢化物中沸点较低的是D。
(2)Al元素的原子序数是13,在元素周期表中的位置是第三周期ⅢA族。B的最高价氧化物对应的水化物是氢氧化钠,含有离子键的离子化合物,电子式为![]() 。
。
(3)O、Cl、Ca可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,则该化合物是次氯酸钙。次氯酸盐具有强氧化性,能与氯离子反应生成氯气,反应的离子方程式为ClO-+2H++Cl-=Cl2↑+H2O。

【题目】已知:相关物质的溶度积常数见表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
现有某酸性CuCl2溶液中含有少量的FeCl2 , 为得到纯净的CuCl22H2O晶体,按如图步骤进行提纯:
(1)最适合作氧化剂X的是(填字母),加入X的目的是 . A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000molL﹣1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32﹣═S4O62﹣+2I﹣)①可选用作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为 .
③该试样中CuCl22H2O的质量百分数为 .