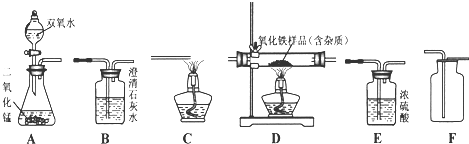
题目内容
18.设计实验方案是科学探究的重要环节.以下化学实验设计中,能达到实验目的是( )| A. | 用铜和稀硫酸反应制取硫酸铜溶液 | |
| B. | 用石灰石除去氯化钙溶液中混有的盐酸 | |
| C. | 用氢氧化钠溶液除去二氧化碳中混有的氯化氢气体 | |
| D. | 用酚酞试液检验暴露在空气中的NaOH固体是否变质 |
分析 A.Cu与稀硫酸不反应;
B.石灰石与盐酸反应生成氯化钙;
C.二氧化碳、HCl均与NaOH溶液反应;
D.变质混有碳酸钠,水溶液均显碱性.
解答 解:A.Cu与稀硫酸不反应,则不能用铜和稀硫酸反应制取硫酸铜溶液,故A错误;
B.石灰石与盐酸反应生成氯化钙,且不引入新杂质,则用石灰石除去氯化钙溶液中混有的盐酸,故B正确;
C.二氧化碳、HCl均与NaOH溶液反应,不能除杂,应选饱和碳酸氢钠溶液除杂,故C错误;
D.变质混有碳酸钠,水溶液均显碱性,则用酚酞试液不能检验,可选石灰水检验,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯及检验等,把握物质的性质及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)?2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
下列说法正确的是( )
 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
| A. | 实验2比实验1的反应容器内压强减小 | |
| B. | 实验2比实验l使用了效率更高的催化剂 | |
| C. | 实验1比实验3的平衡常数大 | |
| D. | 实验2和实验3可判断该反应是放热反应 |
13.下列过程属于化学变化的是( )
| A. | 矿石粉碎 | B. | 海水晒盐 | C. | 生铁冶炼 | D. | 水果榨汁 |
10.推理是化学学习中常见的思维方法.下列推理正确的是( )
| A. | 酸能使紫色石蕊试液变红,二氧化碳也能使紫色石蕊变红,所以二氧化碳是酸 | |
| B. | 某物质在空气中燃烧后生成二氧化碳和水,则该物质中一定含有氧元素 | |
| C. | 向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,说明该溶液中可能存在SO42- | |
| D. | 溶液中有晶体析出,其溶质的质量减少,所以溶质的质量分数一定减小 |
7.如图是CsCl晶体中的一个晶胞,相邻的两个Cs+的核间距为acm,NA为阿伏伽德罗常数,CsCl的相对分子质量用M表示,则CsCl晶体的密度为( )g/cm3
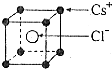

| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$ | B. | $\frac{6M}{{N}_{A}•{a}^{3}}$ | C. | $\frac{4M}{{N}_{A}•{a}^{3}}$ | D. | $\frac{M}{{N}_{A}•{a}^{3}}$ |
8.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
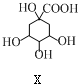 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$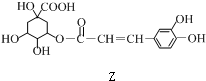
下列有关叙述中不正确的是( )
 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$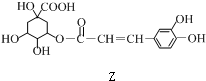
下列有关叙述中不正确的是( )
| A. | X分别与足量的Na、NaOH反应,消耗两者的物质的量之比为5﹕1 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1 mol Z与浓溴水反应最多消耗4molBr2 | |
| D. | 1 mol Z与足量NaOH溶液反应,最多消耗4mol NaOH |
 ;
;