题目内容
【题目】有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
(1)H元素在周期表中属于 ______ 区.G的基态原子电子排布式为 ______ CD2+中C的杂化类型是 ______
(2)下列说法不正确的是 ______ .
a.B2A2分子中含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形 d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B>G
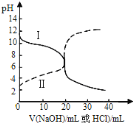
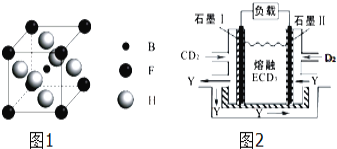
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中.晶胞如图1所示,该晶体的化学式为 ______
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为 ______
【答案】d 1s22s22p63s23p2 sp杂化 cef MgNi3C NO2+NO3--e-=N2O5
【解析】
A、B、C、D、E、F、G、H八种元素的原子序数依次增大,B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为C元素;B、G同族,则G为Si元素;H的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子,故原子核外电子排布为1s22s22p63s23p63d84s2, H为Ni; F的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2;D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素、故F为Mg; C的原子序数介于碳、氧之间,则C为N元素; A原子的核外电子数与电子层数相等,其原子序数在8种元素中最小,则A为H,又A、E同主族, E为Na元素,据此进行解答。
(1)H为Ni元素,Ni的基态原子的核外电子排布为1s22s22p63s23p63d84s2,在周期表中属于d区;G为Si元素,其原子核外电子总数为14,其基态原子电子排布式为:1s22s22p63s23p2;CD2+为NO2+,NO2+中价层电子对个数分别是2,所以中心原子N原子采取sp杂化;
(2)a.B2A2分子为C2H2,乙炔分子中含有3个σ键和2个π键,故a正确;
b.B2A2分子为乙炔,A2D2为双氧水,双氧水分子间存在氢键,则乙炔的沸点明显低于双氧水,故b正确;
c.A2D2分子为H2O2,双氧水分子是每个氧原子含有2个共用电子对且含有2个孤电子对,所以其价层电子对数是4,氧原子采用sp3杂化,所以其空间构型为V型,故c错误;
d.B、C、D分别为C、N、O,非金属性越强,电负性越强,则电负性大小为:O>N>C,故d正确;
e. C、N、O同周期,随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为C<O<N,故e错误;
f.H2+为Ni2+,BD为CO,由于Ni2+含有空轨道,所以二者能够形成配离子[Ni(CO)]2+,故f错误;
g.B和G的单质分别为金刚石、晶体Si,二者形成的晶体为原子晶体,晶体类型相同,由于共价键碳碳键较短,则沸点:C>Si,故g正确;
故答案为:cef;
(3)B为C、F为Mg、H为Ni元素,根据均摊原则,晶胞中C原子数目=1、Ni元素数目=6×![]() =3、Mg原子数目=8×
=3、Mg原子数目=8×![]() =1,故该晶体的化学式为MgNi3C;
=1,故该晶体的化学式为MgNi3C;
(4)根据图示可知,通O2一极为正极,石墨Ⅱ电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,石墨Ⅰ电极反应为:NO2+NO3--e-=N2O5;

 优加精卷系列答案
优加精卷系列答案