题目内容
10. 在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.
在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.(1)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.本次滴定不需要选择指示剂(填“需要”、“不需要”).判断滴定达终点的现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
(2)若滴定管起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为$\frac{2W}{67}$mol•L-1(填表达式).
(3)若滴定完毕立即读数,测定的KMnO4溶液的浓度偏低(填“偏高”、“偏低”或“不变”).
分析 (1)KMnO4具有强氧化性,能腐蚀碱式滴定管的橡皮管;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点;
(2)线根据滴定管的结构、精确度以及测量原理来读数,再根据关系式KMnO4~5Na2C2O4来计算;
(3)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(2)KMnO4具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点,无需指示剂;
故答案为:酸式;不需要;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(3)由题图可知V(KMnO4)=20.70 mL-0.70 mL=20.00 mL,设KMnO4的物质的量浓度为x,
则:KMnO4 ~5Na2C2O4
2moL 5×134g
0.02L×c $\frac{W}{5}$g
解得:c=$\frac{2W}{67}$mol•L-1
故答案为:$\frac{2W}{67}$mol•L-1;
(4)溶液变色因局部过量而实际未达终点,立即读数会造成V(标准)减小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,所测结果偏低,故答案为:偏低.
点评 本题主要考查了氧化还原反应滴定,涉及指示剂的原理、化学计算以及误差分析,考查了学生分析问题和解决问题的能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
1.某同学利用图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.
| 实验操作 | 预期的现象与结论 |
| 步骤1:取1-2mL上述溶液于试管甲中,向里面再滴入几滴KSCN溶液,振荡 | 有溶液变血红色现象,则证明有Fe3+,若无该现象,则证明不含Fe3+. |
| 步骤2:另取1-2mL上述溶液于试管乙中,向里面再滴入几滴KMnO4溶液,振荡 | 有KMnO4溶液紫色褪去现象,则证明有Fe2+,若无该现象,则证明不含Fe2+. |
| 步骤3:综合步骤1.2 | 得出结论 |
2.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 78g过氧化钠固体与足量的水反应,转移的电子数目为2NA | |
| B. | Fe在1molCl2中充分燃烧,转移的电子数目为3NA | |
| C. | 将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| D. | 足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |

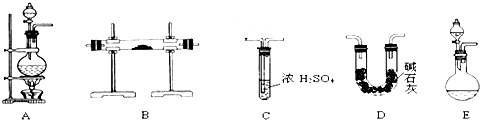
 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示. ;
;  ;
;