题目内容
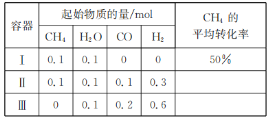
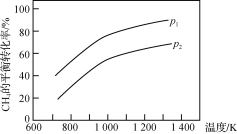
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。
下列说法错误的是
A. 该反应的ΔH>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ<2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比:pⅡ∶pⅢ=4∶5
【答案】AD
【解析】
由图可知,升高温度,CH4的平衡转化率,平衡向正反应方向移动,则该反应为吸热反应;该反应是一个气体体积增大的反应,增大压强,平衡向逆反应方向移动。
A项、该反应是一个气体体积增大的反应,增大压强,平衡向逆反应方向移动,由图可知压强P2> P1,故A错误;
B项、由容器Ⅰ中数据可知,平衡时CH4、H2O、CO、H2的浓度依次为![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L,则平衡常数K=
mol/L,则平衡常数K=![]() =
=![]() =
=![]() ,温度不变,平衡常数不变,容器Ⅱ中浓度熵Qc=
,温度不变,平衡常数不变,容器Ⅱ中浓度熵Qc=![]() =
=![]() =
=![]() >K,平衡向逆反应方向移动,则v(CH4)正<v(CH4)逆,故B正确;
>K,平衡向逆反应方向移动,则v(CH4)正<v(CH4)逆,故B正确;
C项、由等效平衡可知,容器Ⅱ中CH4、H2O、CO、H2的起始物质的量依次为0.2mol、0.2mol、0、0,则恒容条件下,容器Ⅱ相对于容器Ⅰ相当于增大压强,若平衡不移动,达到平衡时n(CO)Ⅱ=2n(CO)Ⅰ,因该反应是一个气体体积增大的反应,增大压强,平衡向逆反应方向移动,则n(CO)Ⅱ<2n(CO)Ⅰ,故B正确;
D项、由等效平衡可知,容器Ⅱ中CH4、H2O、CO、H2的起始物质的量依次为0.2mol、0.2mol、0、0,容器Ⅲ中CH4、H2O、CO、H2的起始物质的量依次为0.2mol、0.3mol、0、0,起始时两容器总压强之比pⅡ∶pⅢ=4∶5,容器Ⅲ相对于容器Ⅱ的条件变化为增大H2O的浓度,平衡向气体体积增大的正反应方向移动,容器压强增大,则平衡时两容器总压强之比pⅡ∶pⅢ<4∶5,故D错误;
故选AD。

 阅读快车系列答案
阅读快车系列答案【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 |
B.反复颠倒摇匀 |
C.用胶头滴管加蒸馏水至刻度线 |
D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为______________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度___________。