题目内容
18.为除去CO2气体中混有的少量SO2气体杂质,可以采用的方法是( )| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
分析 除去二氧化碳中的二氧化硫,利用二氧化硫的还原性、亚硫酸的酸性大于碳酸来分析.
解答 解:澄清石灰水、NaOH溶液、饱和Na2CO3溶液与二氧化碳、二氧化硫都反应,所以不能除杂,二氧化硫具有强还原性,与酸性高锰酸钾溶液发生氧化还原反应,而CO2气体不反应,所以通过酸性高锰酸钾溶液可以除去二氧化碳中的二氧化硫,
故选:A.
点评 本题考查气体的除杂,根据杂质的性质确定除杂剂,侧重分析及实验能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 酸雨和温室效应都与化石燃料的使用有关 | |
| B. | 水体富营养化主要是因为水中含有较多的碳、氮等元素 | |
| C. | 天然气水合物,又称可燃冰,其主要可燃成分是氢气 | |
| D. | 聚酯纤维和光导纤维都是有机高分子材料 |
6.某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)下列说法正确的是( )
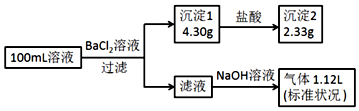

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
13.下列叙述正确的是( )
| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
3.某气态烃1mol能与2mol HBr完全加成,加成后产物分子上的氢原子又可被4mol Cl2完全取代,则此气态烃可能是( )
| A. | CH≡CH | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH2=C(CH3)2 |
8.下列分散系中.分散质粒+直径最小的是( )
| A. | KC1 溶液 | B. | Fe (OH)3胶体 | C. | 牛奶 | D. | 石灰乳 |