题目内容
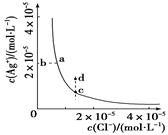
某温度时,AgCl(s)  Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是
 Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是
| A.加入AgNO3,可以使溶液由c点变到d点 |
| B.加入少量水,平衡右移,Cl-浓度减小 |
| C.d点没有AgCl沉淀生成 |
| D.c点对应的Ksp等于a点对应的Ksp |
D
试题分析:A. 加入AgNO3,使溶液中Ag+的浓度增大,由于KSP只与温度有关,温度没变,KSP就不变。Cl-的浓度减小。而溶液c点与d点的Cl-离子的浓度相等。错误。B.加入少量水,对溶液中的离子的浓度起到了稀释作用。平衡右移,这时溶液中的沉淀会继续溶解电离,最终使溶液中的各种离子的浓度保持不变。错误。C.在d点时由于C(Ag+)?C(Cl-)>KSP,所以会产生AgCl沉淀。错误。D.由于这是在某一温度时的AgCl的沉淀溶解平衡曲线。物质的溶度积常数只与温度有关,而与物质的浓度无关。所以c点对应的Ksp等于a点对应的Ksp。正确。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 Ag+(aq)+C1-(aq)
Ag+(aq)+C1-(aq) mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
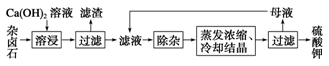
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: