题目内容
沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s) mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp= 。(写出计算过程)
MmAn(s)
 mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp= 。(写出计算过程)
(1)3(4分)
(2)Ca(OH)2的物质的量=0.74g/74 g·mol-1=0.01mol 2分
c(Ca2+)=0.01mol/0.1L=0.1 mol·L-1; 1分
c(OH-)=0.02 mol/0.1L=0.2 mol·L-1 1分
Ksp=c(Ca2+)·c2(OH-) 2分
=0.1×0.22=4×10-3 (mol3·L-3) 2分
(2)Ca(OH)2的物质的量=0.74g/74 g·mol-1=0.01mol 2分
c(Ca2+)=0.01mol/0.1L=0.1 mol·L-1; 1分
c(OH-)=0.02 mol/0.1L=0.2 mol·L-1 1分
Ksp=c(Ca2+)·c2(OH-) 2分
=0.1×0.22=4×10-3 (mol3·L-3) 2分
试题分析:(1)根据氢氧化铁的溶解平衡Fe(OH)3(s)
 3OH-(aq)+Fe3+(aq)可知,Ksp=c(Fe3+)·c3(OH-)=1×10-38。当溶液中铁离子浓度等于10-5 mol·L-1时,溶液中c(OH-)=
3OH-(aq)+Fe3+(aq)可知,Ksp=c(Fe3+)·c3(OH-)=1×10-38。当溶液中铁离子浓度等于10-5 mol·L-1时,溶液中c(OH-)= =
= =1×10-11mol/L,则溶液中氢离子浓度=1×10-14÷1×10-11=1×10-3mol/L,所以溶液的pH=3。
=1×10-11mol/L,则溶液中氢离子浓度=1×10-14÷1×10-11=1×10-3mol/L,所以溶液的pH=3。(2)0.74gCa(OH)2的物质的量=
 =0.01mol
=0.01mol则氢氧化钙的物质的量浓度=
 =0.1mol/L
=0.1mol/L其中c(Ca2+)=0.1 mol·L-1
c(OH-)=2×0.1mol/L=0.2 mol·L-1
根据氢氧化钙的溶解平衡Ca(OH)2(s)
 2OH-(aq)+Ca2+(aq)可知
2OH-(aq)+Ca2+(aq)可知Ksp=c(Ca2+)·c2(OH-)=0.1×0.22=4×10-3(mol3·L-3)

练习册系列答案
相关题目
 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( ) Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
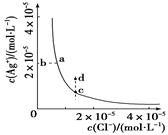
Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。