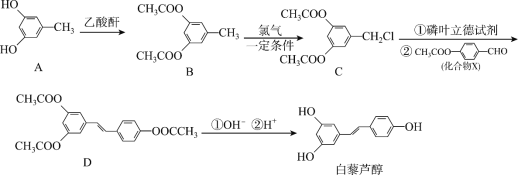
题目内容
【题目】向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
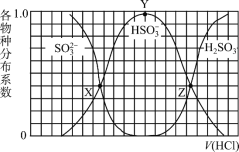
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2OHSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
【答案】A
【解析】
A.在Z点c(H2SO3)=c(HSO3-),由![]() ,则有
,则有![]() ,则pH=-lgc(H+)=-lgKa1,A正确;
,则pH=-lgc(H+)=-lgKa1,A正确;
B.根据图示,从X点到Y点,SO32-的浓度减少,而HSO3-的浓度在增加,则加入盐酸发生的主要反应为SO3-+H+=HSO3,B错误;
C.当V(HCl)=672mL时,n(HCl)=0.672L÷22.4L·mol-1=0.03mol。溶液中的NaOH和Na2SO3的物质的量均为1L×0.01mol·L-1=0.01mol,通入0.03molHCl,NaOH完全反应,Na2SO3转化为H2SO3。H2SO3为弱酸,可经第一二步电离产生HSO3-和SO32-,其关系是c(HSO3-)>c(SO32-)>0,C错误;
D.若将HCl换为NO2,NO2会与水反应,3NO2+H2O=2HNO3+NO,生成的HNO3有强氧化性,可以氧化Na2SO3,溶液中将没有SO32-、HSO3-、H2SO3等粒子,Y点位置会消失,D错误。
答案选A。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目