题目内容
【题目】硫酸铵是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备硫酸铵的工艺流程如下:
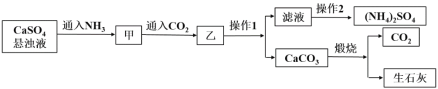
下列说法不正确的是
A. 操作1为过滤,操作2为蒸馏
B. 滤液中的主要阳离子可通过向少量滤液中加NaOH溶液,加热,并用湿润的红色石蕊试纸来检验
C. 甲到乙反应的离子方程式为CaSO4+2NH3+CO2+H2O==CaCO3↓+2NH4++ SO42-
D. 工艺流程中产生的CO2可循环利用
【答案】A
【解析】
流程中,向硫酸钙浊液中通入足量的氨气,使溶液呈碱性,再通入适量的二氧化碳,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,加热硫酸铵溶液制成饱和溶液,再降温冷却结晶,过滤,得到硫酸铵晶体;碳酸钙煅烧生成氧化钙和二氧化碳,据此分析解答。
A.操作1为过滤,操作2是溶液中得到溶质固体的过程,需要蒸发浓缩、冷却结晶、过滤洗涤干燥等,故A错误;B.滤液中阳离子为铵根离子,向少量滤液中加NaOH溶液,加热,生成能使湿润的红色石蕊试纸变蓝的气体氨气来检验铵根离子,故B正确;C.硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀物质发生的主要化学反应为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4,反应的离子方程式为:CaSO4+2NH3+CO2+H2O═CaCO3↓+2NH4++SO42-,故C正确;D.反应过程中二氧化碳参与反应生成硫酸铵和碳酸钙,碳酸钙分解生成二氧化碳,工艺流程中产生的CO2可循环利用,故D正确;故选A。

【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
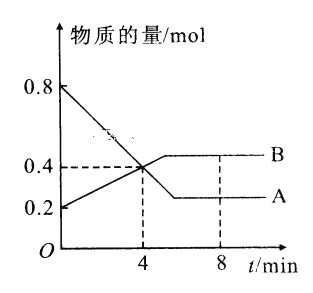
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
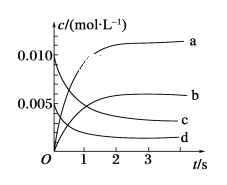
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变