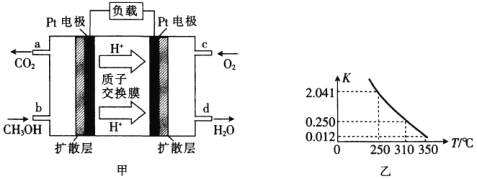
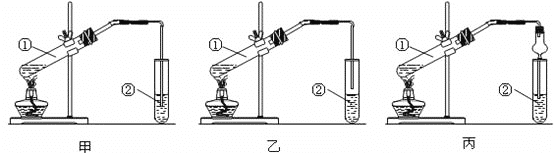
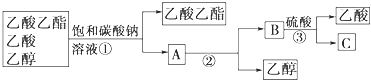
题目内容
【题目】(1)典型物质的电子式
NH4Cl:__________Na2O2:________CO2:___________-OH:__________
(2)某短周期元素含氧酸的化学式为HXO3,其气态氢化物的化学式为HX,则X元素在周期表中的位置为_______。
(3)石油的综合利用方法有四种,其中____的目的是提高轻质油的产量,_____主要是得到甲烷、乙烯、丙烯等化工原料,_______是从石油中获得苯、甲苯等化工原料。
(4)填写有机除杂试剂
C2H6(C2H4) __________
乙酸乙酯(乙酸或乙醇)_____
乙醇(水)____________
苯(溴)________________
(5)无机方程式书写
①海带提碘的氧化环节,使用稀硫酸酸化的双氧水氧化I-的离子方程式为_______
②海水提溴吸收塔(SO2的水溶液)中的反应离子方程式为__________
③以金红石(主要成分TiO2)为原料生产金属钛的步骤主要有:
a.高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体__________
b.在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛_____
(6)有机方程式书写
①乙醇去氢催化氧化生成乙醛的化学方程式:_______
②对苯二甲酸与乙二醇在一定条件下发生缩聚反应生成涤纶的化学方程式:___
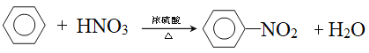
③苯的硝化反应____________
【答案】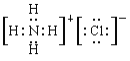
![]()
![]()
![]() 第三周期ⅦA族 裂化 裂解 催化重整 溴水 饱和Na2CO3溶液 生石灰 NaOH溶液 2I-+2H++H2O2=I2+2H2O Br2+SO2+2H2O=4H++SO42-+2Br- TiO2+2C+2Cl2
第三周期ⅦA族 裂化 裂解 催化重整 溴水 饱和Na2CO3溶液 生石灰 NaOH溶液 2I-+2H++H2O2=I2+2H2O Br2+SO2+2H2O=4H++SO42-+2Br- TiO2+2C+2Cl2![]() TiCl4+2CO TiCl4+2Mg
TiCl4+2CO TiCl4+2Mg![]() Ti+2MgCl2 2CH3CH2OH+O2
Ti+2MgCl2 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O 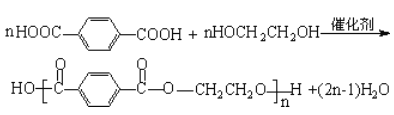
【解析】
(1)NH4Cl中含有离子键和共价键,电子式为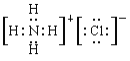 ;Na2O2中含有离子键和共价键,电子式为
;Na2O2中含有离子键和共价键,电子式为![]() ;CO2中含有共价键,电子式为
;CO2中含有共价键,电子式为![]() ;-OH的电子式为
;-OH的电子式为![]() ;
;
(2)某短周期元素含氧酸的化学式为HXO3,其气态氢化物的化学式为HX,这说明X的最低价是-1价,因此X的最高价是+7价,由于F没有含氧酸,所以X元素只能是氯元素,氯元素在周期表中的位置为第三周期ⅦA族。
(3)石油的综合利用方法有四种,其中裂化的目的是提高轻质油的产量,裂解主要是得到甲烷、乙烯、丙烯等化工原料,催化重整是从石油中获得苯、甲苯等化工原料。
(4)乙烯能与溴水发生加成反应,乙烷不能,因此除去C2H6中的C2H4的选择的试剂是溴水;饱和碳酸钠溶液能与乙酸反应,能溶解乙醇,降低乙酸乙酯的溶解度,所以除去乙酸乙酯中的乙酸或乙醇选择的试剂是饱和Na2CO3溶液;乙醇和水互溶,因此除去乙醇中的水选择生石灰,然后蒸馏即可;溴能与氢氧化钠溶液反应,苯不能,因此除去苯中的溴可以选择NaOH溶液;
(5)①海带提碘的氧化环节,使用稀硫酸酸化的双氧水氧化I-的离子方程式为2I-+2H++H2O2=I2+2H2O;
②海水提溴吸收塔(SO2的水溶液)中二氧化硫还原单质溴,反应离子方程式为Br2+SO2+2H2O=4H++SO42-+2Br-;
③以金红石(主要成分TiO2)为原料生产金属钛的步骤主要有:
a.高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,根据原子守恒可知可燃性气体是CO,反应的方程式为TiO2+2C+2Cl2![]() TiCl4+2COspan>;
TiCl4+2COspan>;
b.在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛,同时还有氯化镁生成,方程式为TiCl4+2Mg![]() Ti+2MgCl2;
Ti+2MgCl2;
(6)①乙醇去氢催化氧化生成乙醛的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
②对苯二甲酸与乙二醇在一定条件下发生缩聚反应生成涤纶的化学方程式为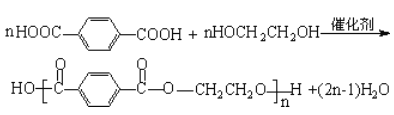 ;
;
③苯的硝化反应方程式为 。
。