��Ŀ����
����Ŀ����ĺܶ��������Ҫ�����á�
��1���ʻ���COS��������ʳѬ�������ܷ�ֹijЩ���桢�߳�������Σ������ĩ״��KSCN��Ũ������һ�������¿ɵõ�COS�������������Ρ����������������εĻ�ѧʽ�ֱ���________ ��__________��
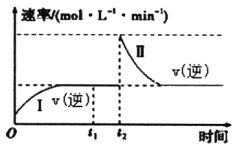
(2)����̼ˮ�⼰����Ӧ��������ͼ��ʾ(���ֲ�������ȥ)
![]()
����֪M��Һ����Ԫ�ص���Ҫ������ʽΪS2O32-����Ӧ��������S2O32-�����ӷ���ʽΪ________________��
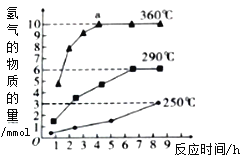
����ͼ�Ƿ�Ӧ���У��ڲ�ͬ��Ӧ�¶��£���Ӧʱ����H2�����Ĺ�ϵ(Na2S��ʼ����Ϊ3mol)����ͼ�������֪��a��ʱM��Һ�г�S2O32-�⣬��һ������_______(����������ӷ���)
��2��H2S���л�ԭ�ԣ������������£�����KMnO4��Ӧ����S��MnSO4��K2SO4��H2O��д���÷�Ӧ�Ļ�ѧ����ʽ_________________________��
��3��H2S��������ˮ�γɵ���������һ�ֶ�Ԫ���ᣬ25��ʱ����0.10mol��L��1��H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c��S2������ϵ��ͼ��ʾ��������Һ����ı仯��H2S�Ļӷ�����
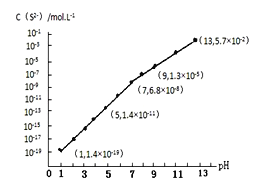
��pH=13ʱ����Һ�е�c��H2S����c��HS����=____________mol��L��1��
��ij��Һ��0.020 mol.L-Mn2����0.10 mol.L��1H2S������ҺpH=____________ʱ��Mn2����ʼ������[��֪��Ksp(MnS)=2.8��10-13]��
��4��H2S�ķ��������ռ���Һ���գ����ռ�����H2S�����Һ���뵽��ͼ��ʾ�ĵ��ص����������е�⡣
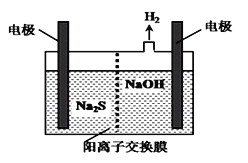
���������������������·�Ӧ��
S2����2e��=S�� ��n��1��S��S2��![]() Sn2��
Sn2��
��д�����ʱ�����ĵ缫��Ӧʽ��_____________��
��Na2S��Һ������Ũ���ɴ�С˳��__________��
���𰸡� KHSO4��������أ� NH4HSO4��������泥� 2S2-+5H2O![]() S2O32-+4H2��+2OH- SO42- 5H2S��2KMnO4��3H2SO4=5S����2MnSO4��K2SO4��8H2O 0.043 5 2H����2e��=H2������2H2O��2e��=H2����2OH���� c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)
S2O32-+4H2��+2OH- SO42- 5H2S��2KMnO4��3H2SO4=5S����2MnSO4��K2SO4��8H2O 0.043 5 2H����2e��=H2������2H2O��2e��=H2����2OH���� c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)
����������1���÷�ӦΪ��������ԭ��Ӧ��Ԫ�ػ��ϼ۾��������仯������ԭ���غ���ɼ���������ص㣬��֪������ʽ�ηֱ�Ϊ��KHSO4��������أ���NH4HSO4��������泥�����ȷ�𰸣�KHSO4��������أ���NH4HSO4��������泥���
��2���ٸ��������Ϣ��֪��Na2S��-2�������ߵ�S2O32-�е�+2������������Ӧ���ָ��������������������ɣ���֪��Ӧ����ˮ�е�����+1�۽��͵�0�ۣ�������ԭ��Ӧ�����ӷ���ʽΪ2S2-+5H2O![]() S2O32-+4H2��+2OH- ����ȷ����2S2-+5H2O
S2O32-+4H2��+2OH- ����ȷ����2S2-+5H2O![]() S2O32-+4H2��+2OH- ��
S2O32-+4H2��+2OH- ��
�ڷ�Ӧ���У�a��ʱ�¶�360�棬����ʱ�����ƣ������������䣬Na2S��ʼ����Ϊ3mol����ֻ����2S2-+5H2O![]() S2O32-+4H2��+2OH- ��Ӧ����������6mol��ͼ������Ϊ10 mol���õ��ӵ������࣬ʧ���ӵ���Ҳ�����࣬˵����Һ�г���S2O32-�⣬��Ӧ��SO42-���ɣ���ȷ�𰸣�SO42-��
S2O32-+4H2��+2OH- ��Ӧ����������6mol��ͼ������Ϊ10 mol���õ��ӵ������࣬ʧ���ӵ���Ҳ�����࣬˵����Һ�г���S2O32-�⣬��Ӧ��SO42-���ɣ���ȷ�𰸣�SO42-��
��2��H2S��-2�۵���������0����������KMnO4��+7�۵��̱���ԭ��+2�۵��̣���Ϊ����ء������̣���Ӧ�Ļ�ѧ����ʽΪ��5H2S��2KMnO4��3H2SO4=5S����2MnSO4��K2SO4��8H2O����ȷ����5H2S��2KMnO4 + 3H2SO4=5S����2MnSO4��K2SO4��8H2O��
��3���ٸ���ͼ�б仯���ɿ�֪��pH=13ʱ��c��S2����=5.7��10-2 mol��L��1��0.10mol��L��1��H2S��Һ�У���Ԫ���غ㣺c��H2S����c��HS����+ c��S2����=0.10������c��H2S����c��HS����=0.1-5.7��10-2=0.043 mol��L��1����ȷ�𰸣�0.043��
�ڸ���QC= Ksp(MnS)ʱ��ʼ���������ԣ�Ksp(MnS)=c(Mn2+)��c(S2-)=2.8��10-13, ��c(Mn2+)=0.020 mol.L-1ʱ��c(S2-)=1.4��10-11 mol.L-1������ͼ����Ϣ��֪��Һ��pH=5����ȷ�𰸣�5��
��4��������Ϊ��Һ�������ӵõ��ӱ�Ϊ����������ӦΪ2H����2e��=H2������2H2O��2e��=H2����2OH��������ȷ�𰸣�2H����2e��=H2������2H2O��2e��=H2����2OH������
��������ҺΪǿ����������ˮ���Լ�����c(OH-)> C(H+)��������ˮ���������S2-+H2O![]() HS-+OH- ��HS-+H2O
HS-+OH- ��HS-+H2O![]() H2S+OH-��������c(S2-)>c(OH-)>c(HS-)>C(H+)��Na2S��Һ������Ũ���ɴ�С˳��c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)����ȷ����c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)��
H2S+OH-��������c(S2-)>c(OH-)>c(HS-)>C(H+)��Na2S��Һ������Ũ���ɴ�С˳��c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)����ȷ����c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)��