题目内容
【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
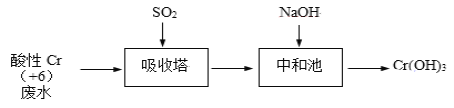
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
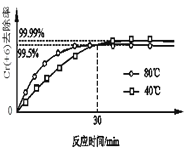
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。
【答案】pH越大,Cr(+6)的去除率降低,反应速率越慢 4 b 30min后反应达到平衡状态,反应为放热反应,升温平衡逆向进行,80℃的Cr(+6)去除率低 增强溶液的导电能力 Fe-2e-=Fe2+
【解析】
(1)①根据图表数据,pH越大,反应越慢,铬离子的最大去除率减小;②pH<4,反应速率快,二氧化硫未来得及反应逸出,会污染空气,pH>4,反应速率减慢,铬离子去除率减小;③a.根据溶液的酸碱性对平衡Cr2O72-+H2O2CrO42-+2H+的影响判断;b.平衡常数只与温度有关;c.SO32-、Fe2+等具有还原性;据此分析判断;
(2)30min前反应未达到平衡状态,开始反应正向进行,反应物转化率增大,30min后反应大多平衡状态,反应为放热反应,升温平衡逆向进行,反应物转化率减小;
Ⅱ、阳极铁失去电子生成亚铁离子,阴极上氢离子得到电子生成氢气;加入适量的NaCl可增强溶液的导电性,据此分析解答。
Ⅰ、(1)①根据表格数据,随pH增大,铬离子的最大去除率减小,反应所需时间越长,pH=6时不符合排放标准,由上述数据获得的结论有:pH越大,Cr(+6)的去除率降低,反应速率越慢,故答案为:pH越大,Cr(+6)的去除率降低,反应速率越慢;
②pH<4,反应速率快,二氧化硫未来得及反应逸出污染空气,pH>4,反应速率减慢,铬离子去除率减小,不能达到排放标准,且铬离子形成氢氧化铬会堵塞管道,所以实际工业生产控制pH=4左右,故答案为:4;
③a.Cr2O72-+H2O2CrO42-+2H+,该酸性含铬废水中一定含有CrO42-,增大pH,氢离子浓度减小,平衡正向移动,CrO42-含量变大,故a正确;b.K只与温度有关,其他条件不变,增大压强,吸收塔中反应的K不变,故b错误;c.理论上看,SO32-、Fe2+等具有还原性,+6价铬元素的化合物具有氧化性,也可以用于除去Cr(+6),故c正确;故答案为:b;
(2)30min前反应正向进行,温度高,反应速率快,反应物的转化率增大,80℃的Cr(+6)去除率比40℃高,30min后,80℃条件下的反应达到平衡状态,反应为放热反应,升高温度,平衡逆向移动,80℃的Cr(+6)去除率低,故答案为:30min后反应达到平衡状态,反应为放热反应,升温平衡逆向移动,80℃的Cr(+6)去除率低;
Ⅱ、(1)因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电能力;
(2)Fe为阳极,为活性电极,则铁失去电子生成Fe2+,所以阳极的电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
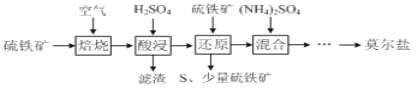
小学生10分钟应用题系列答案【题目】硫酸亚铁铵![]() 又称莫尔盐,是浅绿色晶体。用硫铁矿
又称莫尔盐,是浅绿色晶体。用硫铁矿![]() 主要含
主要含![]() 、
、![]() 等
等![]() 制备莫尔盐的流程如下:
制备莫尔盐的流程如下:
已知:“还原”时,![]() 与
与![]() 不反应,
不反应,![]() 通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:![]()
![]() 写出“还原”时
写出“还原”时![]() 与
与![]() 发生还原反应Ⅱ的离子方程式:__________。
发生还原反应Ⅱ的离子方程式:__________。
实验室检验“还原”已完全的方法是__________。
![]() “还原”前后溶液中部分离子的浓度见下表
“还原”前后溶液中部分离子的浓度见下表![]() 溶液体积变化忽略不计
溶液体积变化忽略不计![]() ,请计算反应Ⅰ、Ⅱ中被还原的Fe
,请计算反应Ⅰ、Ⅱ中被还原的Fe![]() 的物质的量之比__________。
的物质的量之比__________。
离子 | 离子浓度 | |
还原前 | 还原后 | |
|
|
|
|
|
|
![]() 称取
称取![]() 新制莫尔盐,溶于水配成250mL溶液。取
新制莫尔盐,溶于水配成250mL溶液。取![]() 该溶液加入足量的
该溶液加入足量的![]() 溶液,得到白色沉淀
溶液,得到白色沉淀![]() ;另取
;另取![]() 该溶液用
该溶液用![]() 酸性溶液滴定,当
酸性溶液滴定,当![]() 恰好完全被还原为
恰好完全被还原为![]() 时,消耗溶液的体积为
时,消耗溶液的体积为![]() 。试确定莫尔盐的化学式
。试确定莫尔盐的化学式![]() 请写出计算过程)________________。
请写出计算过程)________________。
【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)
【题目】下列依据相关实验得出的结论正确的是
选项 | 实验步骤 | 现象 | 结论 |
A | 浓硫酸与乙醇加热,产生的气体X直接通入溴水 | 溴水褪色 | X一定是纯净的乙烯 |
B | 某卤代烃CH3CH2X与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加 | 生成淡黄色沉淀 | X为溴原子 |
C | 向苯酚溶液中滴加少量浓溴水、振荡, | 无白色沉淀 | 苯酚浓度小 |
D | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液 | 均有白色沉淀 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D

