题目内容
9. (1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):①H2O,②H2和O2.从能量转换的角度看,过程Ⅱ应是化学能转化为电能.
(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):①H2O,②H2和O2.从能量转换的角度看,过程Ⅱ应是化学能转化为电能.(2)图中的燃料电池也可以用A和氧气为原料.已知A分子是由碳和氢两元素的原子构成,并且8.00g A中含有3.01×1023个分子.实验测得在298K时,1mol该气体完全燃烧生成液态水和二氧化碳,放出890kJ的热量.
①写出该气体的化学式:CH4.
②写出1mol该气体燃烧时的热化学反应方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol.
③已知1mol液态的水变成气态水时需要吸收44kJ的热量,则1mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为802kJ.
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极方程式为O2+H2O+4e-═4OH-.
分析 (1)分析转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气;过程Ⅱ是发生的原电池反应;
(2)①8.00g A中含有3.01×1023个分子,可计算M(A)=$\frac{8g}{0.5mol}$=16g/mol;
②1mol该气体完全燃烧生成液态水和二氧化碳,放出890kJ的热量,则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol;
③已知1mol液态的水变成气态水时需要吸收44kJ的热量,1mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为,即生成2mol气态水,则放出的热量为890kJ-2×44kJ=802kJ;
④氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应;氧气得电子是氧化剂,发生还原反应.
解答 解:(1)转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气,两个框中的①、②为循环过程中反应物和生成物的分子式为:①为H2O;②为H2、O2;过程Ⅱ是发生的原电池反应,能量变化是化学能转化为电能的过程,
故答案为:H2O;H2和O2;化学;电;
(2)①8.00g A中含有3.01×1023个分子,即0.5mol,则M(A)=$\frac{8g}{0.5mol}$=16g/mol,应为CH4,故答案为:CH4;
②1mol该气体完全燃烧生成液态水和二氧化碳,放出890kJ的热量,则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol;
③已知1mol液态的水变成气态水时需要吸收44kJ的热量,1mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为,即生成2mol气态水,则放出的热量为890kJ-2×44kJ=802kJ,
故答案为:802;
④氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应;氧气得电子是氧化剂,发生还原反应.电解质溶液是KOH溶液(碱性电解质),正极是O2得到电子,正极的电极反应式为:O2+H2O+4e-═4OH-,负极发生的反应为:H2-2e-+2OH-═2H2O,
故答案为:O2+H2O+4e-═4OH-.
点评 本题考查较为综合,涉及化学反应与能量的变化、热化学方程式,原电池等知识,为高频考点,侧重于学生分析、计算能力的考查,注意把握化学反应过程中能量变化形式,原电池原理的分析应用,注意知识积累,题目较简单.


| A. | H+H→H-H | |
| B. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| C. | Mg+2HCl═MgCl2+H2↑ | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
| A. | 常温常压下,15g乙烷分子中含有的碳氢键数目为3NA | |
| B. | 标准状态下,22.4L的苯的分子数为NA | |
| C. | 通常状态下,1.7g的NH3中含有中子数为NA | |
| D. | 23gNa放入水中反应后共失去电子2NA |
| A. | 植被破坏,粉尘随风飘扬 | B. | 生活生产中以原煤为原料 | ||
| C. | 生活污水的随意排放 | D. | 汽车排放的尾气 |
| A. | K+ NH4+ HCO3- OH- | B. | Fe2+ H+ NO3- SO42- | ||
| C. | Na+ Cu2+ SO42- NO3- | D. | Al3+ Ba2+ CO32- Cl- |
①残留在试管内壁上的碘,用酒精洗涤
②试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
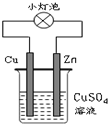
| A. | 该装置实现化学能转变为电能 | |
| B. | 该装置中Cu2+向Cu电极移动 | |
| C. | 该装置中Cu棒上Cu2+发生氧化反应析出Cu | |
| D. | 该装置中Zn棒上的电极反应为:Zn-2e-═Zn2+ |
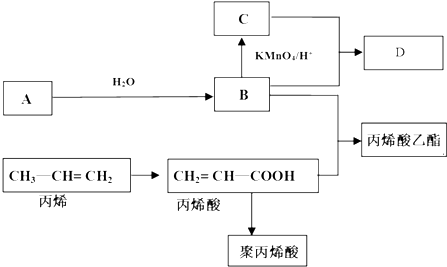
 CH2=CH-COOC2H5+H2O反应类型:酯化反应或取代反应
CH2=CH-COOC2H5+H2O反应类型:酯化反应或取代反应 .
.