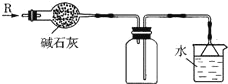
题目内容
【题目】硼氢化钠(NaBH4)在化工领域具有重要的应用价值,可采用硼砂、SiO2、Na和H2作为原料制备。回答下列问题:
(1)周期表中,与B的化学性质最相似的邻族元素是____;该元素基态原子核外M层电子中自旋状态相同的有_____个。
(2)NaBH4中,电负性最大的元素是____(填元素符号);B的____杂化轨道与H的1s轨道形成![]() 键。
键。
(3)硼砂是含8个结晶水的四硼酸钠。其阴离子(含B、O、H三种元素)的球模型如图所示:
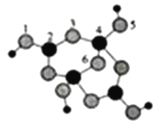
①阴离子中,配位键存在于____和____原子之间。(均填原子的序号)
②硼砂的化学式为_______。
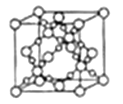
(4)SiO2晶胞(立方体)如图所示,已知SiO2的密度为![]() g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
【答案】Si 3 H sp3 4 5 Na2B4O5(OH)4·8H2O 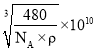
【解析】
(1)在周期表中,与B的化学性质最相似的邻族元素是Si,硅元素基态原子核外M层电子排布式为3s23p2,所以有3个电子的自旋状态相同;
(2)电负性规律:同周期,从左到右:电负性依次增大;同主族,从上到下:电负性依次减小。NaBH4中电负性最大的元素为H;依据价层电子理论,NaBH4中B的价层电子对数为4,为sp3杂化。
(3)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化;B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间;
②硼砂晶体由Na+、含有B的阴离子和H2O构成。观察模型,可知含有B的阴离子是(H4B4O9)m,依据化合价H为+1,B为+3,O为2,可得m=2,结合模型图和组成,硼砂的化学式为Na2B4O5(OH)4·8H2O;
(4)SiO2晶胞中,大球是Si,小球是O。Si的数目为![]() ,O是Si的2倍,故是16。晶体的密度
,O是Si的2倍,故是16。晶体的密度![]() ,晶胞的体积V=a3。因此SiO2晶胞的边长a=
,晶胞的体积V=a3。因此SiO2晶胞的边长a=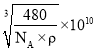 。
。

 阅读快车系列答案
阅读快车系列答案