题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为______________________;可观察到的实验现象是________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)呼吸面具的原理:________________,_______________________。
(4)填写a、b、c化学式并书写①、②的离子方程式(a、b、c均为含Al化合物);
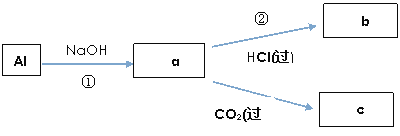
a:____________,b:_____________,c:____________;
①____________________________________________;
②____________________________________________;
(5)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为___________________________,反应的离子方程式是________________________________________________。
【答案】强2Na+2H2O=2Na++2OH-+H2↑bc2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2NaAlO2AlCl3Al(OH)32Al+2OH-+2H2O=2AlO2-+3H2↑AlO2-+4H+=Al3++2H2OFeCl3红生成红褐色沉淀Fe3++3OH-=Fe(OH)3↓
【解析】
(1)同周期自左向右金属性逐渐减弱,因此钠元素的金属性比铝的强。
(2)将一小块金属钠投入水中,与水反应生成氢氧化钠和氢气,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;a.钠的密度小于水,钠漂浮在水面上,a错误;b.反应放热且钠的熔点较低,因此钠熔成小球,b正确;c.反应放出氢气,且反应剧烈,所以小球四处游动,c正确;答案选bc;
(3)过氧化钠能与水或二氧化碳等反应放出氧气,因此可以作呼吸面具中的供氧剂,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,则a是NaAlO2,偏铝酸钠与过量的盐酸反应生成氯化钠、氯化铝和水,则b是AlCl3,偏铝酸钠与过量的二氧化碳反应生成碳酸氢钠和氢氧化铝,则c是Al(OH)3。反应①的方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应②的方程式为AlO2-+4H+=Al3++2H2O;
(5)Fe跟Cl2在一定条件下反应生成氯化铁,所得产物的化学式是FeCl3。将该产物溶于水配成溶液,分装在两支试管中,则
a.若向其中一支试管中滴加KSCN溶液,则溶液变成红色。
b.向另一支试管中滴加NaOH溶液发生复分解反应生成氢氧化铁和氯化钠,因此现象为生成红褐色沉淀,反应的离子方程式是Fe3++3OH-=Fe(OH)3↓。

【题目】某同学用NaHCO3和KHCO3组成的混合物进实验,测得的实验数据如下表所示(盐酸的物质的量浓度相同):(计算结果保留3位有效数字)
实验编号 | ① | ② | ③ |
盐酸体积(mL) | 50 | 50 | 50 |
混合物的质量(g) | 9.2 | 15.7 | 27.6 |
标准状况下CO2的体积(L) | 2.24 | 3.36 | 3.36 |
回答下列问题:
(1)由实验______________(填实验编号)可判断盐酸完全反应,理由是_____________。
(2)盐酸的物质的量浓度为__________________。
(3)产生标准状况下3.36LCO2所需固体的质量为______________________。
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。