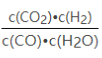题目内容
【题目】阅读题目,回答问题。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为________________________________,Cl—Cl 键的键能为_________________________。
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的__________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_________________________。
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图
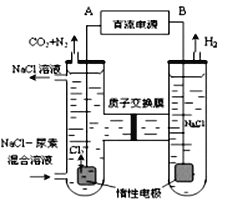
①电源的负极为_____________(填“A”或“B”)。
②阳极室中发生的反应为_____________________,______________________。
③电解结束后,阴极室溶液的pH 与电解前相比将____________________。
【答案】 PCl3(g)+Cl2(g)=PC15(g) ΔH=![]() kJ·mol-1 (b-a+5.6c)/4 kJ·mol-1 负 4Al2Cl7-+e-=A1+7AlCl4- B 2C1--2e-= Cl2↑ CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl 不变
kJ·mol-1 (b-a+5.6c)/4 kJ·mol-1 负 4Al2Cl7-+e-=A1+7AlCl4- B 2C1--2e-= Cl2↑ CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl 不变
【解析】(1)设已知中的两个热化学方程式分别为:①P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1,②P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1,根据盖斯定律,(②-①)÷4得:PCl3(g)+Cl2(g)=PC15(g) ΔH=![]() kJ·mol-1;焓变=反应物键能之和-生成物键能之和,用E(Cl-Cl)表示Cl—Cl键的键能,可得:E(Cl-Cl)+3×1.2c-5c=
kJ·mol-1;焓变=反应物键能之和-生成物键能之和,用E(Cl-Cl)表示Cl—Cl键的键能,可得:E(Cl-Cl)+3×1.2c-5c=![]() kJmol-1,解得E(Cl-Cl)=(b-a+5.6c)/4 kJ·mol-1。
kJmol-1,解得E(Cl-Cl)=(b-a+5.6c)/4 kJ·mol-1。
(2)根据电镀原理,钢铁上镀铝,铝做阳极与电源正极相连,钢铁做阴极与电源负极相连,则钢制品应接电源的负极;电解质溶液为:有机阳离子、Al2Cl7-和AlCl4-,因为该离子液体是一种室温熔融盐,为非水体系,电镀过程中不产生其他离子且有机阳离子不参与电极反应,所以阴极发生还原反应生成铝,铝元素的化合价降低,根据离子液体成分,结合电荷守恒分析可得,应为Al2Cl7-得电子,电极反应式为:4Al2Cl7-+3e-=Al+7AlCl4-。
(3)①如图该装置为电解池,左室进入NaCl和尿素混合液,产生了Cl2、CO2和N2,发生氧化反应,故A为电源正极,所以B为电源的负极,右室电解产物为H2,发生还原反应。②由图可知,阳极室首先是Cl-放电生成Cl2,然后Cl2再氧化尿素生成氮气和二氧化碳,同时生成HCl,故阳极室中发生的反应为:2C1-2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。③阴极反应为2H2O+2e-=2OH-+H2↑,根据两极的反应及电子守恒可看出,两极上产生的OH-、H+的数目相等,阳极室中产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以电解结束后,阴极室溶液的pH与电解前相比不变。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案