题目内容
【题目】某中学探究性学习小组拟用锌粒与足量稀盐酸反应测定通常状况(约20 ℃,1 atm)下H2的气体摩尔体积。设计实验装置和实验步骤如下:
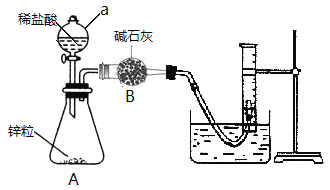
①连接如图所示装置,并检查装置的气密性
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为m g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为n g;
⑦处理数据等。
(1)仪器a的名称为_____________。
(2)写出锥形瓶中发生反应的离子方程式____________________________________________________________。
(3)写出检查装置A气密性的方法______________________________________________________________________。
(4)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=__________________________L·mol-1(用含m、b、n等字母的代数式表示)。
(5)若拆除B仪器(其他仪器不变),_______________________________(填“会”或“不会”)对本实验产生影响,理由是______________________________________________________________________________________________。
【答案】 分液漏斗 Zn+2H+=Zn2++H2↑ 关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好 Vm=2b×10-3/(m-n)L·mol-1 会 H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响
【解析】(1)根据装置图可知仪器a的名称为分液漏斗;(2)锥形瓶中发生反应中利用盐酸与锌发生置换反应生成氢气和氯化锌,反应的方程式为Zn+2HCl═ZnCl2+H2↑;(3)根据压强差的原理可以检查该装置气密性,具体操作为关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(4)根据上述数据可知,氢气的体积为b mL,氢气的质是为mg-ng,所以氢气物质的量为![]() mol,H2的摩尔体积Vm=
mol,H2的摩尔体积Vm=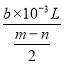 mol=
mol=![]() L/mol;(5)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响。
L/mol;(5)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D