题目内容
【题目】氨在国防、工农业等领域发挥着重要作用。工业以甲烷为原料生产氨气的过程如下:![]()
(1)过程Ⅰ中,有关化学反应的能量变化如下图所示

反应①为___________(“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式是________________。
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ )溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(1),
[Cu(NH3)3]CH3COOCO(1), ![]()
①N元素在周期表中的位置为__________,NH3的电子式为__________。
②所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是__________(选填字母)。
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
(3)合成NH3的反应为放热反应,如果该反应平衡时,只改变一个条件,再次达到新平衡时,平衡常数K值变大。关于该反应的说法正确的是__________(填字母序号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大再减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小再增大
(4)400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡时N2转化率为60%。该温度下的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(5)一种直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是_____________。
②用该电池电解300mL的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
【答案】 吸热 CH4(g) + H2O(g) = CO(g) + 3H2 (g) △ H = +118.1kJ/mol 第二周期第ⅤA族 ![]() b AD 0.021(MPa)-2 或
b AD 0.021(MPa)-2 或![]() (MPa)-2 2NH3 -6e- + 3O2- =N2 + 3H2O 0.224L
(MPa)-2 2NH3 -6e- + 3O2- =N2 + 3H2O 0.224L
【解析】(1)由图可得热化学方程式为:①CH4(g) + 2H2O(g) = CO2(g) + 4H2 (g) H = +76.9kJ/mol,②CO(g) + H2O(g) = CO2(g) + H2 (g) H = -41.2kJ/mol,根据盖斯定律①-②得:CH4(g) + H2O(g) = CO(g) + 3H2 (g) H = +118.1kJ/mol,故答案为:吸热;CH4(g) + H2O(g) = CO(g) + 3H2 (g) H = +118.1kJ/mol。
(2)①N元素在元素周期表中位于第二周期第VA族,NH3的电子式为:![]() ,故答案为:第二周期第VA族;
,故答案为:第二周期第VA族;![]() ;②吸收CO后的乙酸二氨合铜溶液经过适当处理后又可再生,回复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)
;②吸收CO后的乙酸二氨合铜溶液经过适当处理后又可再生,回复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(1),H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生原理,故再生适宜条件是高温低压,答案为:b。
[Cu(NH3)3]CH3COOCO(1),H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生原理,故再生适宜条件是高温低压,答案为:b。
(3)化学平衡常数只与温度有关,合成氨反应为放热反应,该反应平衡时,如果只改变一个条件,再次达到平衡时,平衡常数K值变大,说明温度降低,平衡向正反应方向移动,逆反应速率先减小再增大,故AD正确
(4)10分钟后反应达到平衡时N2转化率为60%,则反应的N2的物质的量为0.6mol,列三段式:

氮气、氢气、氨气的平衡分压分别为![]() ×28MPa=4MPa,12MPa,12MPa,所以平衡常数Kp=
×28MPa=4MPa,12MPa,12MPa,所以平衡常数Kp=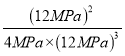 =
=![]() (MPa)-2。
(MPa)-2。
(5)①此燃料电池中,负极为NH3发生氧化反应,与固体电解质中的O2-生成N2和H2O,电极反应式:2NH3-6e-+3O2-=N2+3H2O。②电解后溶液pH=13,则OH-浓度为0.1mol/L,溶液体积0.3L,则OH-物质的量为0.03mol,故电解过程中转移的电子为0.03mol,由电子守恒和电极反应式2NH3-6e-+3O2-=N2+3H2O可知,消耗的NH3为0.01mol,标准状况下的体积为0.224L。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案






