题目内容
【题目】I.尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如图转化:

下列说法错误的是(____)
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D.对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
II.1,6一己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如图1:

回答下列问题:
(1)化合物A的质谱图如图2,则A的化学名称为___________。
(2)B→C的反应类型为___________。D→E的反应类型为______________。
(3)F的结构简式为____________。
(4)由G合成尼龙的化学方程式为_______________,与G含有相同官能团的同分异构体有_______种,其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是___________(写出一种即可)。
由A通过两步反应制备1,3-环己二烯的合成路线为_____________________。
(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() )
)
【答案】 D 环己烯 加成反应 氧化反应 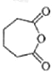
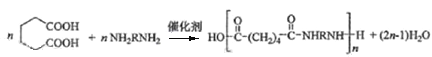 8
8 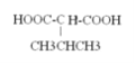 或
或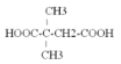
![]()
![]()
![]()
![]()
【解析】I.A.酪氨酸中氨基能与盐酸反应,―COOH、―OH能与NaOH溶液反应,故A正确;B.1mol尿黑酸与足量浓溴水反应,酚羟基的邻位可被取代,最多消耗3molBr2 ,故B正确;C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个苯环上6个加与苯环相连的1个,故C正确;D.对羟基苯丙酮酸分子核磁共振氢谱有5个峰,无手性碳原子,故D错误;故选D。II.(1)化合物A的质谱图如图2,得A的式量为82,由商余法82/12=6余10,C6H12,结合流程图,则A的化学名称为环已烯;(2)B→C的反应类型为与水发生加成反应;D得氧原子变成E,反应类型为氧化反应;(3) 发生氧化反应生成F,F的结构简式为
发生氧化反应生成F,F的结构简式为 ;(4)由G合成尼龙的化学方程式为
;(4)由G合成尼龙的化学方程式为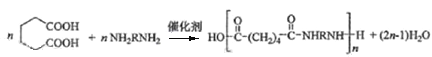 ;与G含有相同官能团的同分异构体有8种,
;与G含有相同官能团的同分异构体有8种, 其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是
其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是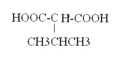 或
或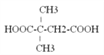 ;由A通过两步反应制备1,3-环己二烯的合成路线为
;由A通过两步反应制备1,3-环己二烯的合成路线为 ![]()
![]()

![]()
![]()

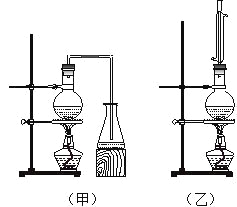
【题目】实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质
如下表:
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。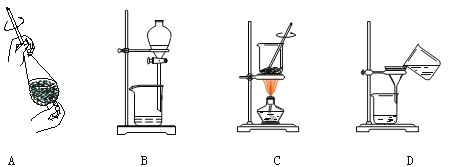
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。