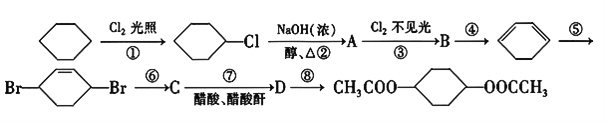
��Ŀ����
����Ŀ���Ի�����Ϊԭ�����������������ķ������������÷������Լ��ٻ�����Ⱦ�����Ϊ������ҵ�����÷���(��Fe2����Fe3���������μ�����CaO��MgO)�Ʊ��ߵ���������(Fe2O3)�ͻ���(NH4)2SO4�����������������£�
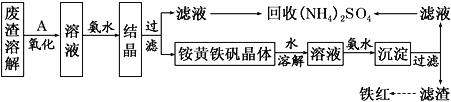
(1)�ڷ����ܽ����ʱ��Ӧѡ��________�ܽ�(����ĸ)��
A����ˮ B������������Һ C������ D������
(2) Ϊ����߷����Ľ�ȡ�ʣ��ɲ��õĴ�ʩ����Щ��_______________������д�����㣩��
(3)����A��һ������������ҵ�����ѡ��________(��ѡ��ʹ�õ��У�������Cl2��MnO2)����������_______________�����������з�����Ӧ�����ӷ���ʽΪ_________________��
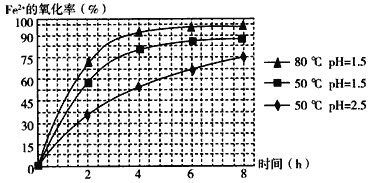
(4)������ͼ�й����ݣ�����Ϊ��ҵ����������ʱӦ���Ƶ�����(���¶ȡ�pH������ʱ��������˵��)�ǣ�______________________________________________________��
(5) 炙������п��ܻ��е�������Fe(OH)3��________��
(6) 炙������Ļ�ѧʽ�ɱ�ʾΪ(NH4)xFey(SO4)z(OH)w���仯ѧʽ��ͨ������ʵ��ⶨ��
�� ��ȡһ����������Ʒ����ϡ�������ܽ⣬��������Һת��������ƿ�����Ƴ�100.00 mL��ҺA��
�� ��ȡ25.00 mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32 g��
�� ��ȡ25.00 mL��ҺA����������NaOH��Һ�����ȣ��ռ�����״��������448mL��ͬʱ�к��ɫ�������ɡ�
�� �����������ó������ˡ�ϴ�ӡ����գ����յù���4.80 g��
ͨ�����㣬��ȷ��炙������Ļ�ѧʽΪ___________________________������֪炙�������Ħ������Ϊ960gmol-1,��������в����ǹ�����ʧ�������ܽ���
���𰸡� D ���������顢���ȡ������ ���� ԭ���ã��ɱ��ͣ���������Ⱦ������������ 4Fe2����O2��4H��===4Fe3����2H2O ��Һ�¶ȿ�����80 �棬pH������1.5������ʱ��Ϊ4 h���� Ca(OH)2��Mg(OH)2��CaSO4 (NH4)2Fe6(SO4)4(OH)12
����������1������֪������̣������к���Fe2����Fe3���������μ�����CaO��MgO���ʷ����ܽ����ʱ��Ӧѡ�������ܽ�ȽϺ��ʣ���ѡD��
��2��Ϊ����߷����Ľ�ȡ�ʣ����Խ�������һ�����飬���������ı������߷�Ӧ���ʣ������Բ��ü��ȡ�����ȷ�����
��3�������ܽ������������Fe2+����ΪFe3+���ṩ��������������ֻ�п�����O2������ɫ��������ԭ���á��ɱ��͡�����Fe2+��������Ⱦ���������������ʣ������ѡ�ÿ�������Ӧ��ѧ����ʽΪ��4Fe2+��O2��4H+=4Fe3+��2H2O��
��4�����������߿ɵã���ͬʱ���ڣ�80 �桢pH=1.5ʱ��Fe2����ת������ߣ���Ӧѡ����������ȡ4Сʱ֮�����ӳ�ʱ��ת������߲��ʽ�ȡ4Сʱ�Ϻ��ʣ����Ϸ�������ҵ����������ʱӦ���Ƶ������ǣ���Һ�¶ȿ�����80 �棬pH������1.5������ʱ��Ϊ4 h���ҡ�
��5�����������Һ���Ӱ�ˮ�ᾧ�����ó�������炙����������⣬Fe3+��Mg2+��Ca2+Ҳ�������������炙������п��ܻ��е�������Fe(OH)3��Mg(OH)2��Ca(OH)2��CaSO4��
��6���ɢڵã�n��SO42-��=n��BaSO4��=9.32g��233gmol-1=0.04mol���ɢ۵ã�n��NH4+��=n��NH3��=0.448L��22.4Lmol-1=0.02mol���ɢܵã�n��Fe��=2n��Fe2O3��=2��4.8g��160gmol-1=0.06mol�����ԣ����(NH4)xFey(SO4)z(OH)w������Ϊ(NH4)xFe3x(SO4)2x(OH)w�����������ϼ۴�����Ϊ0�ã�w=6x������Ϊ(NH4)xFey(SO4)z(OH)w��Ħ������Ϊ960gmol-1�����Ի�ѧʽΪ��(NH4)2Fe6(SO4)4(OH)12

����Ŀ�������йط�Ӧ�ȵ���������ȷ���ǣ� ��
���±����ݿ��Լ����  ��g��+3H2��g����
��g��+3H2��g���� 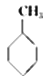 ��g���ķ�Ӧ�ȣ�
��g���ķ�Ӧ�ȣ�
���ۼ� | C��C | C�TC | C��H | H��H |
����/��kJmol��1�� | 348 | 610 | 413 | 436 |
����֪2H2��g��+O2��g���T2H2O��g����H=��483.6kJmol��1�� ��������ȼ����Ϊ��H=��241.8kJmol��1
���ɵ���Aת��Ϊ����B��һ�����ȹ��̣��ɴ˿�֪����B�ȵ���A�ȶ�
��X��g��+Y��g���TZ��g��+W��s����H��0�����º��������´ﵽƽ������X��������Ӧ�ġ�H����
���ɸ�˹���ɣ���֪����ͬ�����£����ʯ��ʯīȼ������1molCO2����ʱ���ų���������ȣ�
��25�棬101kPaʱ��1mol̼��ȫȼ������CO2���ų�������Ϊ̼��ȼ���ȣ�
A. �٢ڢۢ� B. �ۢܢ� C. �ܢ� D. ��