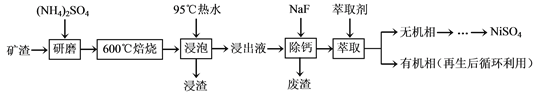
题目内容
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A. “对电极”是负极
B. “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O
C. 传感器工作时H+由工作电极移向对电极
D. 对电极的材料可能为活泼金属锌
【答案】C
【解析】“工作电极”通入NO2生成NO,说明被还原,为原电池正极,则“对电极”是负极,原电池工作时,阳离子移向正极,阴离子向负极移动;A、根据以上分析,“对电极”是负极,故A正确;B、“工作电极”上通入NO2生成NO,为原电池的正极,发生的电极反应为NO2+2e-+2H+═NO+H2O,故B正确;C、原电池工作时,阳离子移向正极,传感器工作时H+由对电极移向工作电极,故C错误;D、“对电极”是负极,“对电极”的材料可能为活泼金属锌,故D正确;故选C

练习册系列答案
相关题目