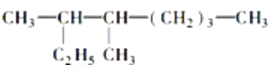题目内容
【题目】用物理方法可以从海水中提取的物质是
A. 食盐 B. 金属镁 C. 溴单质 D. 单质钠
【答案】A
【解析】A. 通过蒸发海水可以获得食盐,属于物理变化,A正确;B. 需要电解熔融的氯化镁得到金属镁,不是物理变化,B错误;C. 海水中的溴离子被氧化变为溴单质,属于化学变化,C错误;D. 电解熔融的氯化钠得到单质钠,属于化学变化,D错误,答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
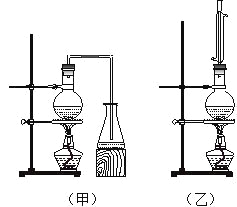
【题目】实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质
如下表:
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。