题目内容
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的 “理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A. 采用多孔电极的目的是提髙电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D. 在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
【答案】C
【解析】A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故A正确;B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为![]() ×2=
×2=![]() mol、
mol、![]() ×3=
×3=![]() mol、
mol、![]() ×2=
×2=![]() mol,所以Al-空气电池的理论比能量最高,故B正确;C.正极上氧气得电子和水反应生成OH-,因为是不阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;故选C。
mol,所以Al-空气电池的理论比能量最高,故B正确;C.正极上氧气得电子和水反应生成OH-,因为是不阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;故选C。

【题目】某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
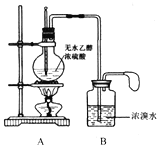
(1)请写出A和B中发生的主要反应的化学方程式
A:________________________________________。
B:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚, ![]()
②乙醚不与溴水反应
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
颜色、状态 | 无色液体 | 无色液体 | 无色液体 |
沸点/℃ | 78.5 | 132 | 34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是____________________。