题目内容
10.当n=4时(n为主量子数,n值所表示的电子运动状态称为电子层),电子层的最大容量为32个电子,如果没有能级交错,该层各轨道的能量由高到低的顺序为4f>4d>4p>4s.分析 根据原子核外电子排布规律,每层最多容纳的电子数为2n2,主量子数为4的电子层为第4层;
根据构造原理该层各轨道的能量由高到低的顺序4f>4d>4p>4s.
解答 解:根据原子核外电子排布规律,每层最多容纳的电子数为2n2.主量子数为4的电子层为第4层,最多能容纳的电子数为2n2=2×42=32;
根据构造原理该层各轨道的能量由高到低的顺序4f>4d>4p>4s;
故答案为:32;4f>4d>4p>4s.
点评 本题考查核外电子的排布规律,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
13.下列实验装置的相关描述不正确的是( )
| A. | 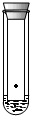 装置可用于叶绿体中色素的分离 | |
| B. | 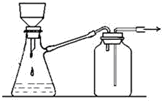 装置可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀 | |
| C. |  装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 | |
| D. | 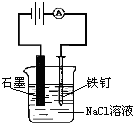 装置不可用来模拟氯碱工业 |
14.在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
| A. | ①②③ | B. | ③④⑥ | C. | ②③⑤⑥ | D. | 只有 ③ |
11.下列说法中正确的是( )
| A. | 1mol H2约含有6.02×1023个微粒 | |
| B. | 水的摩尔质量是18g | |
| C. | 氯化氢的摩尔质量就是它的相对分子质量 | |
| D. | 相同物质的量的SO2和SO3,含氧原子个数之比为2:3 |
5.为了使0.1mol•L-1 Na2CO3溶液中c(CO32-)接近0.1mol•L-1,应采取( )
| A. | 加入少量的碳酸钠固体 | B. | 通入CO2 | ||
| C. | 加入少量盐酸 | D. | 加入少量氢氧化钙固体 |
15.已知1mol X2完全燃烧生成X2O(g)放出热量a kJ,且氧气中1mol O═O键完全断裂时吸收能量b kJ,X2O中1mol X-O键形成时放出能量c kJ,X2中1mol X-X键断裂时吸收能量为( )
| A. | (4c-b+2c)kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
2.依据元素周期表寻找催化剂、耐高温、耐腐蚀的合金材料在( )
| A. | 金属与非金属分界线附近 | B. | 非金属区域 | ||
| C. | 过渡元素 | D. | 左下方的金属元素区域 |
20.下表中实验操作不能达到实验目的或得出不正确结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 当溶液发生过饱和现象时,用玻璃棒轻轻摩擦器壁. | 促使晶体析出 |
| B | 将一块擦去氧化膜的铝片放在浓硝酸中,一段时间后取出洗净,再放入一定浓度的CuSO4溶液中. | 验证Al在浓硝酸中的钝化 |
| C | 在食醋总酸含量测定实验中,用25mL移液管吸取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度线,摇匀得待测食醋溶液 | 主要是防止食醋的挥发而导致实验误差. |
| D | 把两根碳棒放在酒精喷灯火焰上灼烧2~3分钟后,立即投入到冷水中,反复操作3~5次. | 可以使碳棒表面变得粗糙多孔,便于吸收更多的气体 |
| A. | A | B. | B | C. | C | D. | D |
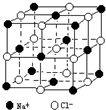 (1)熔点沸点HF>HI;原因:HF分子间含有氢键
(1)熔点沸点HF>HI;原因:HF分子间含有氢键