题目内容
【题目】铋酸钠(NaBiO3)广泛应用于制药业。其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO3,并探究其应用与纯度测定。请按要求回答下列问题:
(1)已知:Bi是N同主族元素,周期序数相差4,则Bi的原子序数为__。
Ⅰ.NaBiO3的制备,实验装置如图(加热和夹持仪器已略去)
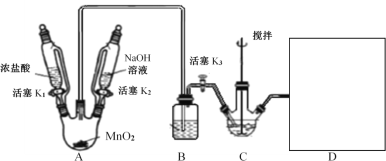
(2)A装置制备的气体是__;B装置的作用是__;补全图中D装置图(并标注试剂名称)___。
(3)C中反应的离子方程式为__。当观察到现象为___时,可以初步判断C中反应已经完成。
(4)反应完成后,处理装置A烧瓶中残留气体需进行的操作:__;为从装置C中获得尽可能多的产品,需进行的操作:__、过滤、洗涤、干燥。
Ⅱ.铋酸钠的应用,检测Mn2+
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是__;同学甲再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,产生此现象的离子反应方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmo1·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液。该产品的纯度为__(用含a、b、V的代数式表示)。
【答案】83 Cl2(氯气) 除去HCl同时冷却氯气  Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O C中固体由白色转变为淡黄色且颜色不再加深 关闭K1、K3,打开K2 在冰水中冷却 将Mn2+氧化为MnO
Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O C中固体由白色转变为淡黄色且颜色不再加深 关闭K1、K3,打开K2 在冰水中冷却 将Mn2+氧化为MnO![]() 3Mn2++2MnO
3Mn2++2MnO![]() +2H2O=5MnO2↓+4H+
+2H2O=5MnO2↓+4H+ ![]() ×100%
×100%
【解析】
A用于制取氯气,浓盐酸具有挥发性导致生成的氯气中含有HCl,HCl极易溶于饱和食盐水,且饱和食盐水能抑制氯气溶解;C中盛放氢氧化铋和氢氧化钠的混合物,与氯气反应生成NaBiO3,氯气有毒,不能直接排放到空气中,但是能和氢氧化钠反应完全消除污染,所以D装置是尾气处理。
(1)Bi是N同主族元素,周期序数相差4,则Bi位于第六周期,第三周期有8种元素,第四、五周期有18种元素,第六周期有32种元素,故其原子序数为7+8+18+18+32=83;
(2)A装置用于制备氯气;由于铋酸钠遇沸水或酸迅速分解,B装置是为了除去HCl同时冷却氯气;D是尾气处理,应盛放氢氧化钠溶液;
故答案为:Cl2(氯气);除去HCl同时冷却氯气; ;
;
(3)根据已知信息可知,Bi(OH)3在NaOH溶液中与Cl2反应可制备NaBiO3,Bi(OH)3白色且难溶于水,NaBiO3粉末呈浅黄色,不溶于冷水;故装置C中的离子方程式为:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O;C中固体由白色转变为淡黄色且颜色不再加深时可以初步判断C中反应已经完成;
故答案为:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O;C中固体由白色转变为淡黄色且颜色不再加深;
(4)反应完成后,处理装置A烧瓶中残留的氯气需要关闭K1、K3,打开K2将NaOH溶液滴入三颈烧瓶中;由于铋酸钠不溶于冷水,为从装置C中获得尽可能多的产品,需在冰水中冷却、过滤、洗涤、干燥;
故答案为:关闭K1、K3,打开K2;在冰水中冷却;
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,则有MnO![]() 生成,故铋酸钠的作用是将Mn2+氧化为MnO
生成,故铋酸钠的作用是将Mn2+氧化为MnO![]() ;再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为3Mn2++2MnO
;再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为3Mn2++2MnO![]() +2H2O=5MnO2↓+4H+;
+2H2O=5MnO2↓+4H+;
故答案为:将Mn2+氧化为MnO![]() ;;3Mn2++2MnO
;;3Mn2++2MnO![]() +2H2O=5MnO2↓+4H+;
+2H2O=5MnO2↓+4H+;
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmo1·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液,由![]() ,
,![]() 可知,5NaBiO3~5H2C2O4,则n(NaBiO3)=
可知,5NaBiO3~5H2C2O4,则n(NaBiO3)=![]() mol,产品的纯度=
mol,产品的纯度=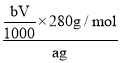 ×100%=
×100%=![]() ×100%。
×100%。

【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
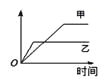
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D