题目内容
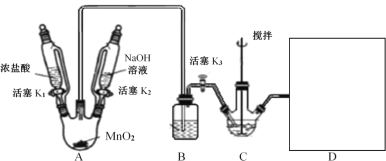
【题目】镍(Ni)及其化合物在工业生产中具有重要地位。如图是工业精制镍的基本流程示意图:
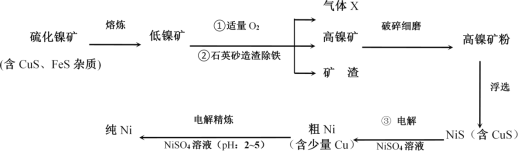
请按要求回答下列问题:
(1)写出流程图中组成气体X的元素中电负性较大的是__(填元素符号)。气体X的中心原子的杂化轨道类型为___,该分子的立体构型(即空间结构)为__。
(2)Ni2+核外电子排布式为__。
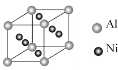
(3)向晶体Ni中掺入一定量的Al原子,会改变晶体Ni的(写一种物理性质)_。某种用于铸造飞机发动机叶片镍铝合金的晶胞结构如图所示,该合金的化学式为_。
(4)已知:常温下溶度积常数:Ksp(NiS)=1.07×10-21;Ksp(CuS)=1.27×10-36
工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+)为0.107mol·L-1,则滤液中残留的c(Cu2+)为_。写出流程图中③NiS在阳极参与放电的电极反应式为__。
【答案】O sp2杂化 V形 [Ar]3d8(或1s22s22p63s23p63d8) 延展性(或硬度、密度、熔点、沸点等) Ni3Al(或AlNi3) 1.27×10-16mol·L-1 NiS2e-=Ni2++S
【解析】
硫化镍矿经熔炼得到低镍矿,通入氧气,产生的气体为SO2,高镍矿经研磨浮选得到NiS,NiS在第三步电解时在阳极失电子,得到S单质。
(1)根据流程图,可知X是SO2,电负性较大的是O,中心原子的杂化轨道类型为sp2杂化,该分子的立体构型(即空间结构)为V形,故本题答案为:O;sp2杂化;V形;
(2)Ni是28号元素,根据电子排布规律,Ni2+核外电子排布式为[Ar]3d8(或1s22s22p63s23p63d8);
(3)向晶体Ni中掺入一定量的Al原子,改变了晶体结构,改变了晶体的延展性(或硬度、密度、熔点、沸点等)等。根据镍铝晶胞结构,Al的个数为![]() ,Ni的个数为
,Ni的个数为![]() ,该合金的化学式为Ni3Al,故本题答案为:延展性(或硬度、密度、熔点、沸点等);Ni3Al;
,该合金的化学式为Ni3Al,故本题答案为:延展性(或硬度、密度、熔点、沸点等);Ni3Al;
(4)过滤后溶液中c(Ni2+)为0.107mol·L-1,则c(S2-)= Ksp(NiS)/ c(Ni2+)=1.07×10-21/0.107=10-20mol·L-1,c(Cu2+)= Ksp(CuS)/c(S2-)=1.27×10-36/10-20mol·L-1=1.27×10-16mol·L-1,图③中NiS在阳极失电子,发生的电极反应为NiS2e-=Ni2++S,故本题答案为:1.27×10-16mol·L-1;NiS2e-=Ni2++S。