��Ŀ����
����Ŀ��NH3��CO2��������Ҫ�Ļ���ԭ�ϣ�
��1����һ���¶��£��ڹ̶�������ܱ������з�����Ӧ��N2+3H22NH3 �� �ÿ��淴Ӧ�ﵽ��ѧƽ��ı�־��������ĸ����a.3v��H2����=2v��NH3����
b����λʱ������mmolN2��ͬʱ����3mmolH2
c�����������ܶȲ�����ʱ��仯
d��amol ![]() �����ѵ�ͬʱ����6amolN��H������
�����ѵ�ͬʱ����6amolN��H������
��2��CO2��NH3�����ںϳ����أ�ԭ���������������ٺϳɰ�������泥�CO2��g��+2NH3��g��=H2NCOONH4��s������H=��159.47kJ/mol
�ڰ�������立ֽ⣺H2NCOONH4��s��=CO��NH2��2��s��+H2O��l��
��H=+28.49kJ/mol����2molCO2��ȫ��Ӧ�ϳ����صġ�H= ��
��3�������ѧ�������Ƴɹ�һ�����ʹ������ܽ�CO2ת��Ϊ���飮�ڳ�ѹ��300�棬CO2��H2�����Ϊ1��4ʱ��Ӧ��CO2ת���ʴ�90%��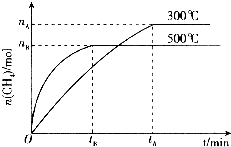
�ٴ˷�Ӧ�Ļ�ѧ����ʽ����
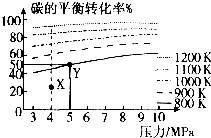
��һ�������£�ij��ȤС�飬�����ΪVL���ܱ������У�ģ��˷�Ӧ�ﵽ��ѧƽ��״̬���÷�Ӧ��ƽ�ⳣ������ʽΪ����ͼ��֪�����¶ȣ�K�������������С�����䡱����300��ʱ���ӷ�Ӧ��ʼ�����ﵽƽ�⣬��H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����������nA��tA��V��ʾ����
���𰸡�
��1��bd
��2����261.96kJ/mol
��3��CO2+4H2 ![]() CH4+2H2O��K=
CH4+2H2O��K= ![]() ������
������![]()
���������⣺��1��a��3v��H2����=2v��NH3���� �� ��ѧ��Ӧ����֮���뻯ѧ������֮�Ȳ��ȣ������淴Ӧ���ʲ��ȣ���a����b����λʱ������mmolN2���淴Ӧ��ͬʱ����3mmolH2������Ӧ���һ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ������淴Ӧ������ȣ���b��ȷ�� c���ܶ�= ![]() �����������䣬������䣬�ʻ��������ܶȲ�����ʱ��仯������Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���c����
�����������䣬������䣬�ʻ��������ܶȲ�����ʱ��仯������Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���c����
d����λʱ����amolN��N���Ķ���������Ӧ��6amolN��H���Ķ������淴Ӧ���һ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ������淴Ӧ������ȣ���d��ȷ�����Դ��ǣ�bd����2���ٺϳɰ�������泥�CO2��g��+2NH3��g��=H2NCOONH4��s������H=��159.47kJ/mol�ڰ�������立ֽ⣺H2NCOONH4��s��=CO��NH2��2��s��+H2O��l����H=+28.49kJ/mol���١�2+�ڡ�2��2CO2��g��+4NH3��g��=2CO��NH2��2��s��+2H2O��l����H=����159.47kJ/mol����2+28.49kJ/mol��2=��261.96kJ/mol�����Դ��ǣ���261.96kJ/mol����3������300�桢���ʹ����������£�һ����̼��������Ӧ���ɼ����ˮ������ʽΪ��CO2+4H2 ![]() CH4+2H2O�����Դ��ǣ�CO2+4H2
CH4+2H2O�����Դ��ǣ�CO2+4H2 ![]() CH4+2H2O���ڻ�ѧƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮������Ӧ��������ﶼ�����壬ƽ�ⳣ������ʽΪK=
CH4+2H2O���ڻ�ѧƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮������Ӧ��������ﶼ�����壬ƽ�ⳣ������ʽΪK= ![]() ����ͼ���֪�����¶ȼ�������ʵ������٣�ƽ�����淴Ӧ�����ƶ���K��С���ԣ�H2��=4�ԣ�CH4��=
����ͼ���֪�����¶ȼ�������ʵ������٣�ƽ�����淴Ӧ�����ƶ���K��С���ԣ�H2��=4�ԣ�CH4��= ![]() =
= ![]() �����Դ��ǣ�K=
�����Դ��ǣ�K= ![]() ����С��
������ ![]() ��
��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ��Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

����Ŀ������һƿ�Ҷ����ͱ������Ļ�����֪���ǵ��������±���ʾ���ݴˣ����Ҷ����ͱ������������ѷ�����
���� | ����ʽ | �۵�/�� | �е�/�� | �ܶ�/(g��cm-3) | �ܽ��� |
�Ҷ��� | C2H6O2 | -11.5 | 198 | 1.11 | ������ˮ�;ƾ� |
������ | C3H8O3 | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
A. ��ȡ�� B. �ᾧ�� C. ��Һ�� D. ����
����Ŀ��һ�������£���2L�����ܱ������г���1molCOCl2(g)������Ӧ��COCl2(g)![]() Cl2(g)+CO(g)����Ӧ�����в�õ��й��������±���
Cl2(g)+CO(g)����Ӧ�����в�õ��й��������±���
t/s | 0 | 2 | 4 | 6 | 8 |
N(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵������ȷ����
A. ʹ�ô����ܹ��ı䷴Ӧ����
B. �ﵽ6sʱ����Ӧֹͣ�����ٽ���
C. ��8sʱ����Ӧ�����и����ʵ�Ũ�Ȳ��ٷ����仯
D. ����Cl2��ƽ����Ӧ���ʣ�0~2s��ƽ�����ʱ�2~4s��