��Ŀ����
����Ŀ����ͼ��һЩ��Ҫ��ҵ������ת����ϵ(��Ӧ������ȥ):
![]()
�������������.
(1)��DΪ���嵥�ʣ���A����ͬһ���������Ԫ�أ���
�ٷ�Ӧ�Ļ�ѧ����ʽ��________________��
��D��ԭ�ӽṹʾ��ͼ��__________��
��D���ʵ�һ����Ҫ��;��____________��
(2)��AΪ��ɫ���壬DΪ��ȼ�����嵥�ʣ���÷�Ӧ�Ļ�ѧ����ʽ_________��
(3)��B��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��
��B���ӵĵ���ʽ��_____________��
��B��һ�������¿���C��Ӧ�������������ʣ���÷�Ӧ�Ļ�ѧ����ʽΪ______��
���𰸡� 2C+SiO2![]() 2CO��+Si
2CO��+Si 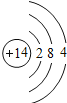 ���뵼����ϵ� C+H2O(g)
���뵼����ϵ� C+H2O(g) ![]() CO+H2
CO+H2 ![]() 4NH3+6NO
4NH3+6NO![]() 5N2+6H2O
5N2+6H2O
��������(1)��D��Aͬ���壬A���û���D���Ҹ÷�Ӧ����Ҫ��Ӧ�������Ԫ�����ڱ�����֪A��C��D��Si����2C+SiO2![]() 2CO��+Si����Si��ԭ�ӽṹʾ��ͼ��
2CO��+Si����Si��ԭ�ӽṹʾ��ͼ�� ���۹赥�ʵ�һ����Ҫ��;���ư뵼����ϣ�(2)��AΪ��ɫ���壬DΪ��ȼ�����嵥�ʣ���÷�Ӧ��̼��ˮ������Ӧ����������CO����Ӧ�Ļ�ѧ����ʽΪC+H2O(g)
���۹赥�ʵ�һ����Ҫ��;���ư뵼����ϣ�(2)��AΪ��ɫ���壬DΪ��ȼ�����嵥�ʣ���÷�Ӧ��̼��ˮ������Ӧ����������CO����Ӧ�Ļ�ѧ����ʽΪC+H2O(g)![]() CO+H2��(3)��B��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬B�ǰ�����A��������C��NO��D��H2O���ٰ������ӵĵ���ʽ��
CO+H2��(3)��B��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬B�ǰ�����A��������C��NO��D��H2O���ٰ������ӵĵ���ʽ��![]() ����B��һ�������¿���C��Ӧ���������������ǵ�����ˮ����÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO
����B��һ�������¿���C��Ӧ���������������ǵ�����ˮ����÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO![]() 5N2+6H2O��
5N2+6H2O��

����Ŀ����֪A��B��C��D��E��F��G������ԭ��������������Ķ�����Ԫ�أ����ǵ�ԭ�ӽṹ�������й����ʵ����ʵ������ʾ��
Ԫ�� | ԭ�ӽṹ�������й����ʵ����� |
A | ԭ�ӵ����������������ڲ��������2�� |
B | �䵥���ǿ����к����������� |
C | ԭ�ӵ�����������������Ӳ�����4�� |
D | λ�ڵڢ�A�壬��ԭ�Ӱ뾶��E�Ĵ� |
E | �ǽ���Ԫ�أ�����������������ﶼ�����ԣ�����D��ͬһ���� |
F | ԭ������16���䵥����ͨ��״����Ϊ���� |
G | ԭ�ӵ��������������������������1�� |
��1��Ԫ��F��Ԫ�����ڱ��е�λ���� �� ������Ԫ���У�����������Ԫ�ص�Ԫ�ص������� ��
��2����E��F��G����Ԫ���У�ԭ�Ӱ뾶��С��������Ԫ�ط��ţ���
��3��Ԫ��A��G���γɻ�����AG4 �� �ڸû������к��еĻ�ѧ������Ϊ �� ���ӵĿռ�ṹΪ �� A����Ԫ�ؿ��γɻ�����AO2 �� �û�������ӵĵ���ʽΪ ��
��4��Ԫ��B������Ԫ���γɻ�����BH3 �� ��ͨ��״���£�BH3��ˮ��Һ������ᡱ��������С����ԣ�ԭ��Ϊ���÷���ʽ��ʾ��





