题目内容
13.下列离子组一定能大量共存的是( )| A. | pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- | |
| B. | 水电离出的c(OH-)=10-12 mo1•L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- | |
| C. | 含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- | |
| D. | CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
分析 A.pH=1,显酸性,MnO4-为紫色;
B.水电离出的c(OH-)=10-12 mo1•L-1的溶液,为酸或碱溶液;
C.离子之间相互促进水解;
D.CO2的饱和溶液中,该组离子之间不反应.
解答 解:A.pH=1,显酸性,该组离子不反应,可大量共存,但MnO4-为紫色,与无色不符,故A不选;
B.水电离出的c(OH-)=10-12 mo1•L-1的溶液,为酸或碱溶液,酸溶液中Fe2+、H+、NO3-(或ClO-)发生氧化还原反应不能大量共存,碱溶液中不能大量存在Fe2+,故B不选;
C.A13+、[Al(OH)4]-相互促进水解生成沉淀,不能大量共存,故C不选;
D.CO2的饱和溶液中,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大,注意常见离子的颜色.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
3.治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O.某学生在实验室用一定量的铜与足量的硝酸反应,收集到标准状况下NO、NO2和N2O4的混合气体共aL.若将上述混合气体通入1L 1mol/L的NaOH溶液中恰好被完全吸收.下列分析错误的是( )
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
4.X、Y、Z、W是原子序数依次增大的短周期元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )
| A. | W在元素周期表中位于笫三周期笫IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的离子化合物,其阳离子与阴离子个数比不一定为2:1 |
1.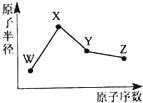 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 对应简单离子半径:W>X | |
| B. | 对应气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW既含离子键,又含共价键 | |
| D. | Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
18.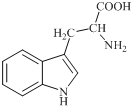 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |
5.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.l mol•L-1丁溶液的pH为13.下列说法正确的是( )
| A. | 元素B在周期表中的位置为第二周期第VIA族 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | |
| C. | 1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 1.0L 0.lmol-L-1戊溶液中阴离子总的物质的量小于0.l mol |
2.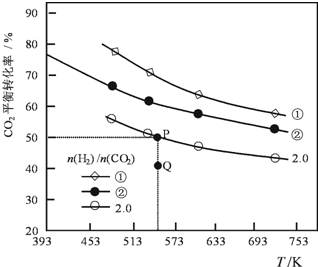 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 氢碳比:①<② | |
| C. | 在氢碳比为2.0时,Q点v(正)<v(逆) | |
| D. | 若起始时,CO2、H2浓度分别为0.5mol•L-1和1.0mol•L-1,则可得P点对应温度的平衡常数的值为512 |
10.下列说法不正确的是( )
| A. | 豆科植物通过根瘤菌吸收空气中的氮是化学变化 | |
| B. | 化石燃料燃烧通常不释放出氮氧化合物 | |
| C. | 汽车尾气中排放的氮氧化合物是由游离态氮转化来的 | |
| D. | 植物秸秆燃烧时放出氮氧化合物,参与了氮的循环 |