题目内容
2.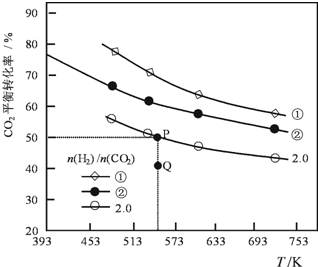 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 氢碳比:①<② | |
| C. | 在氢碳比为2.0时,Q点v(正)<v(逆) | |
| D. | 若起始时,CO2、H2浓度分别为0.5mol•L-1和1.0mol•L-1,则可得P点对应温度的平衡常数的值为512 |
分析 A、由图象可知,温度越高,二氧化碳的平衡转化率越小;
B、加入一种气体反应物,可以增加另一气体反应物的转化率;
C、从Q点移动到P点,二氧化碳的平衡转化率增大;
D、依据此时碳氢比,利用三段法计算即可.
解答 解:A、由图象可知,温度越高,二氧化碳的平衡转化率越小,故此反应为放热反应,故△H<0,故A正确;
B、加入一种气体反应物,可以增加另一气体反应物的转化率,故氢碳比越大,二氧化碳平衡转化率越高,故①>②,故B错误;
C、在氢碳比为2.0时,由Q点升高到P点,二氧化碳的平衡转化率增大,故此时刻平衡右移,即v(正)>v(逆),故C错误;
D、2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)
始态(mol•L-1)0.5 1.0 0 0
转化(mol•L-1)2x 6x x 4x
平衡(mol•L-1)0.5-2x 1.0-6x x 4x
依据图象得出此时二氧化碳的平衡转化率为50%,即$\frac{2x}{0.5}$×100%=50%,解x=0.125,故K=$\frac{c{(C}_{2}{H}_{4})×{c}^{4}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.2{5}^{6}}$=512,故D正确,
故选AD.
点评 本题主要考查的是转化率随温度压强的变化曲线,此题较为新颖,注意依据图象判断此的特点是关键,有一定难度.

练习册系列答案
相关题目
12.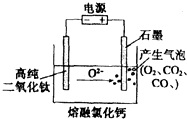 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )| A. | 阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 通电后,O2-、Cl-均向阴极移动 | |
| C. | 阴极的电极反应式为TiO2+4e-=Ti+2O2- | |
| D. | 石墨电极的质量不发生变化 |
13.下列离子组一定能大量共存的是( )
| A. | pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- | |
| B. | 水电离出的c(OH-)=10-12 mo1•L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- | |
| C. | 含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- | |
| D. | CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
10.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6克钠与水反应时失去的电子数目为0.2NA | |
| B. | 1 L0.5mol•L-1 Na2SO4溶液中所含有的Na+离子数日为NA | |
| C. | 在标准状况下,22.4LNH3所含的氨分子数目为NA | |
| D. | 常温常压下2克氢气所含原子数日为NA |
17.下列指定反应的离子方程式正确的是( )
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-=AgCl↓ | |
| C. | Na2S2O3溶液吸收Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++Fe2++3OH-=Fe (OH)2↓+NH3•H2O |
7.下列说法正确的是( )
| A. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| B. | 做衣服的棉、麻、蚕丝的主要成分都是纤维素 | |
| C. | 鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 | |
| D. | 乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
14.化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| D. | 使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染” |
11.亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.

已知:①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排除装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是ac(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)
25°C.

已知:①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排除装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)
25°C.
19.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )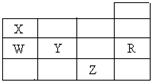

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |