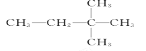��Ŀ����
����Ŀ������β�������е�һ����Ӧ���£�2NO��g��+2CO��g��![]() N2��g��+2CO2��g����H=-373.4kJ/mol������Ӧ�ں��ݵ��ܱ������дﵽƽ��״̬�������й�˵����ȷ���ǣ�������
N2��g��+2CO2��g����H=-373.4kJ/mol������Ӧ�ں��ݵ��ܱ������дﵽƽ��״̬�������й�˵����ȷ���ǣ�������
A.�����������䣬�����������H���
B.���뺤��ʹ��ϵѹǿ������߷�Ӧ���ת����
C.��ʱ��ȥ������̼��������NO��ת��
D.�������¶ȣ��÷�Ӧ��ƽ�ⳣ������
���𰸡�C
��������
A. �����������䣬���������ƽ�ⲻ�����ƶ�����H���䣬A����
B. ���뺤��ʹ��ϵѹǿ�������ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�����ƶ�����Ӧ���ת���ʲ��䣬B����
C. ��ʱ��ȥ������̼��ƽ�������ƶ���������NO��ת����C��ȷ��
D. ��Ϊ����Ӧ�Ƿ��ȷ�Ӧ�������������¶ȣ�ƽ�������ƶ����÷�Ӧ��ƽ�ⳣ����С��D����
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���⼰�仯����������������Ӧ�ù㷺���ش���������:
��1�����ʵ������Ӧ�ɵ�IF5��ʵ�����Һ̬IF5����һ���ĵ�����ԭ������IF5����ż���루��:2H2O![]() H3O++OH-����IF5����ż���뷽��ʽΪ_________
H3O++OH-����IF5����ż���뷽��ʽΪ_________
��2���������ƺ͵������������Һ�еķ�Ӧ��:Na2SO3+KIO3+H2SO4 ��Na2SO4+K2SO4+I2+H2O��δ��ƽ���÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���²�:
��IO3-+SO32-��IO2-+SO42-������
��IO2-+SO32-��IO-+SO42-���죩
��5I-+6H++I03-��3I2+3H2O���죩
��I2+SO32-+H2O-��2I+SO42-+2H+���죩
�������������Ʋ⣬�˷�Ӧ���ܷ�Ӧ������_______����Ӧ����������ţ�����Ԥ�ȼ��˵�����Һ��������������_____________����������ʱ���Ż��е��۱��������������
��3�����ӵ���������Ҫ���о�����
����֪SO2��I2�ķ�Ӧ�����ʼ�����ƽ�ⳣ������Һ�д�������ƽ��:I2(aq)+l-(aq)=l3-(aq)�ֽ�1 mol SO2��ͨ�뺬1mol l2��ˮ��Һ����ǡ����ȫ��Ӧ��Һ��l3-�����ʵ���n(l3-)ʱ�䣨t���ı仯������ͼ1��ʾ����ʼ�Σ�n(l3-)�������ԭ����_____

�ڿ���С�������Ͳ���Ag/TiO2����Һ�е����ӽ��������о�����ͼ2�Dz�ͬpH�����£�����������Ч���ı仯���ߡ��ݴ��ƶ�Ag/TiO2�������ʺ�����___________����������������������������������Һ�е�I-��
���Ȼ�������������Ҳ����Ч�����������Ȼ��������������Ե����ӵ�������ӦΪ:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq)����Ӧ�ﵽƽ�����Һ��c(Cl-)=1.0mol��L-1.����Һ��c(I-)=______mol��L-1��k(AgCl)=2.0��10-10��k(Agl)=8.4��10-17��
��4��Fe3+��I-����Һ�з�����Ӧ:2Fe3++2I- ![]() 2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
c��I-��/molL-1 | c��Fe3+��/molL-1 | v/molL-1s-1 | |
�� | 0.20 | 0.80 | 0.032k |
�� | 0.60 | 0.40 | 0.144k |
�� | 0.80 | 0.20 | 0.128k |
����v=k��cm(I-)��cn(Fe3+)��m��n��ֵΪ_____________������ţ�
A.m=1n=1 B.m=1��n=2 C.m=2��n=1 D.m=2��n=2
��I-Ũ�ȶԷ�Ӧ���ʵ�Ӱ��_____����������������С����������������Fe3+Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣